
| A.若反应X+Y=M+N是放热反应,该反应一定不用加热 |
| B.需要加热才能发生的反应一定是吸热反应 |
| C.原电池正极和负极的材料必须是两种金属 |
| D.铜锌原电池工作时,若有13g锌被溶解,外电路中就有0.4mol电子通过 |
科目:高中化学 来源:不详 题型:填空题
 NH4++OH-。试问N2H4与足量盐酸反应的化学方程式: 。
NH4++OH-。试问N2H4与足量盐酸反应的化学方程式: 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.按键型分类,该晶体中含有非极性共价键 |
| B.含N5+离子的化合物中既有离子键又有共价键 |
| C.高聚氮与N2、N3、N5、N5+、N60互为同素异形体 |
| D.这种固体的可能潜在应用是烈性炸药或高能材料 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.需要加热才能发生的反应就一定是吸热反应 |
| B.燃料的燃烧反应都是放热反应 |
| C.化学反应的能量变化与反应物的总能量、生成物的总能量有关 |
| D.每个化学反应都伴随着能量的变化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CaO+H2O=Ca(OH)2 | ||||
B.2Na+O2
| ||||
C.Fe2O3+2Al
| ||||
D.右图所示的反应为吸热反应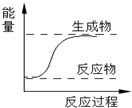 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.燃料的燃烧反应都是放热反应 |
| B.绿色植物进行光合作用时,能把光能转化为化学能 |
| C.分子的热稳定性主要取决于分子内化学键的键能大小,与分子间作用力无关 |
| D.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ?mol-1,则说明相同条件下,在密闭容器中,1molN2和3molH2混合充分反应后放热92.4kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
Si3N4(s)+12HCl(g),在温度T0下的2 L密闭容器中,加入0.30 mol SiC14, 0.20 mol N2. 0.36 mol H2进行上述反应,2min后达到平衡,测得固体的质量增加了2.80 g
| A.该反应在任何温度下可自发进行 |
| B.若混合气体的总质量不变,表明上述反应己达到平衡状态 |
| C.其他条件不变,增大Si3N4的物质的量,平衡向左移动 |
| D.按3:2:6的物质的量比增加反应物,SiC14(g)的转化率降低 |

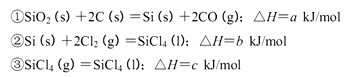
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com