
下列各组微粒属于等电子体的是( )
| A.CO和CO2 | B.NO和NO2 | C.CH4和NH3 | D.CO2和N2O |
科目:高中化学 来源: 题型:单选题
已知BeCl2为共价化合物。 下列对于BeCl2分子的说法正确的是
| A.由极性键构成的极性分子 | B.由非极性键构成的非极性分子 |
| C.由非极性键构成的极性分子 | D.由极性键构成的非极性分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于丙烯(CH3—CH=CH2)的说法正确的是
| A.一个丙烯分子中有8个σ键和1个π键 |
| B.丙烯分子中3个碳原子可能在同一直线上 |
| C.丙烯分子中3个碳原子都是sp3杂化 |
| D.丙烯分子中不存在非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.CHCl3是正四面体形 |
| B.H2O分子中氧原子为sp2杂化,其分子几何构型为V形 |
| C.二氧化碳中碳原子为sp杂化,为直线形分子 |
D.NH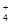 是三角锥形 是三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列叙述正确的是
| A.非金属原子间以共价键结合的物质一定是共价化合物 |
| B.含有共价键的化合物一定是共价化合物 |
| C.凡是能电离出离子的化合物一定是离子化合物 |
| D.凡是含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某元素的原子最外层只有一个电子,它跟卤族元素结合时形成的化学键
| A.一定是共价键 | B.一定是离子键 |
| C.可能是共价键,也可能是离子键 | D.上述说法都不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是
| A.液溴和苯分别受热变为气体 | B.干冰和氯化铵分别受热变为气体 |
| C.二氧化硅和铁分别受热熔化 | D.食盐和葡萄糖分别溶解在水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com