
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | |||
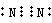 ,N的氢化物为NH3,N原子采取sp3杂化,有1对孤对电子,空间构型为三角锥形,
,N的氢化物为NH3,N原子采取sp3杂化,有1对孤对电子,空间构型为三角锥形,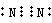 ;sp3;三角锥形;
;sp3;三角锥形;

科目:高中化学 来源: 题型:
| A、原子半径的大小顺序:W>Z>Y>X |
| B、化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂 |
| C、元素Y的简单气态氢化物的热稳定性比W的弱 |
| D、由X、Y、Z、W四种元素组成的化合物对水的电离平衡一定是促进的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
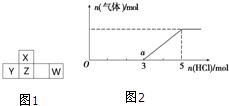 短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.
短周期元素X、Y、Z、W在周期表中的位置如图1所示,其中W的氧化物是酸雨形成的主要物质.| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
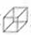 )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线: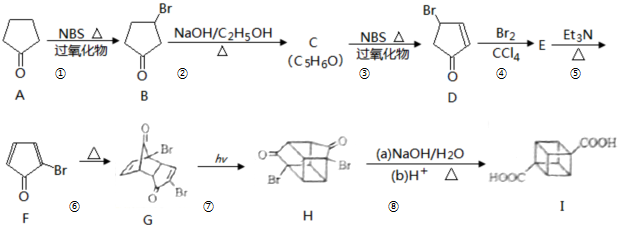

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
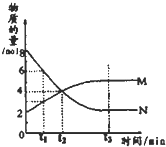 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A、反应的化学方程式为:2M?N |
| B、t2时,正逆反应速率相等,达到平衡 |
| C、t3时,正反应速率大于逆反应速率 |
| D、t3后,若升高温度则反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 等,处于对角关系的元素,其单质、化合物的性质相似.比如铍和铝的相似性超过了它和镁的相似性.下列关于铍及其化合物的性质的叙述,正确的是( )
等,处于对角关系的元素,其单质、化合物的性质相似.比如铍和铝的相似性超过了它和镁的相似性.下列关于铍及其化合物的性质的叙述,正确的是( )| A、Be常温下能与水反应 |
| B、Be(OH)2受热不会分解 |
| C、BeO易与水反应 |
| D、Be(OH)2能与强碱反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com