
【题目】溶液 A中可能含有如下离子:Na+、NH4+、Ba2+、Mg2+、SO42-、SO32-、Cl-、OH-。某同学设计并完成了如下的实验:
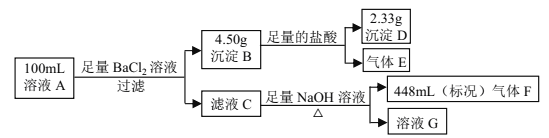
下列说法正确的是
A. 溶液 A 中一定存在 NH4+、 SO42-、 SO32-,可能存在 Na+
B. 溶液 A 中一定存在 NH4+、 Mg2+、 SO42-、 SO32-,可能存在 Cl-
C. 溶液 A 中可能存在 Cl-,且 c(Na+) ≥ 0.20 mol·L-1
D. 如果气体 F 能使湿润的蓝色石蕊试纸变红,说明溶液中一定含有 NH4+
【答案】C
【解析】溶液A中滴加过量BaCl2溶液所得沉淀B溶解于稀盐酸,部分溶解,并得到沉淀D为BaSO4,物质的是来0.01mol,溶解的质量为BaSO3,质量为2.17g,物质的量为0.01mol,由此推断原溶液中含有SO42-和SO32-,物质的量均为0.01mol;排除原溶液中含有Ba2+;滤液C中加入足量NaOH溶液,无沉淀可知溶液中无Mg2+,有气体放出,可知溶液中有NH4+,根据生成氨气448mL,可知溶液中NH4+的物质的量为0.02mol;溶液是电中性的,根据电荷守恒可知,溶液中一定还含有Na+,其物质的量为0.02mol,可能还含有Cl-;A.由分析可知,溶液 A 中一定存在 Na+,故A错误;B.由分析可知,溶液 A 中一定不存在 Mg2+,故B错误;C.由分析可知,溶液 A 中不存在 Cl-时Na+物质的量为0.02mol,若溶液 A 中存在 Cl-,Na+物质的量大于0.02mol,即 c(Na+) ≥ 0.20 mol·L-1,故C正确;D.氨气能使湿润的红色石蕊试纸变蓝,故D错误;答案为C。


 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的说法正确的是
A.有单质参加并生成的反应一定是氧化还原反应
B.氧化还原反应一定有氧元素的得失
C.氧化还原反应的实质是化合价变化
D.氧化还原反应的实质是电子的转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N![]() N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是
N放出942 kJ热量,根据以上信息和数据,判断下列说法正确的是

A. N4属于一种新型的化合物
B. N4分子中存在非极性键
C. N4分子中N—N键角为109°28′
D. 1 mol N4转变成N2将吸收882 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
2 mL | 0.2 mol·L1 Na2SO3溶液 | 饱和Ag2SO4溶液 | Ⅰ.产生白色沉淀 |
0.2 mol·L1 CuSO4 | Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀 | ||
0.1 mol·L1 Al2(SO4)3溶液 | Ⅲ.开始无明显变化,继续滴加产生白色沉淀 | ||
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。用离子方程式解释现象Ⅰ:____________。
(2)经检验,现象Ⅱ的棕黄色沉淀中不含SO42,含有Cu+、Cu2+和SO32。
已知:Cu+![]() Cu +Cu2+,Cu2+
Cu +Cu2+,Cu2+![]() CuI↓(白色)+I2。
CuI↓(白色)+I2。
①用稀硫酸证实沉淀中含有Cu+的实验现象是_____________。
②通过下列实验证实,沉淀中含有Cu2+和SO32。

a.白色沉淀A是BaSO4,试剂1是____________。
b.证实沉淀中含有Cu+和SO32的理由是_______________。
(3)已知:Al2(SO3)3在水溶液中不存在。经检验,现象Ⅲ的白色沉淀中无SO42,该白色沉淀既能溶于强酸,又能溶于强碱,还可使酸性KMnO4溶液褪色。
①推测沉淀中含有亚硫酸根和____________。
②对于沉淀中亚硫酸根的存在形式提出两种假设:i. Al(OH)3所吸附;ii.存在于铝的碱式盐中。对假设ii设计了对比实验,证实了假设ii成立。
将对比实验方案补充完整。
步骤一:

步骤二:

则V1___________V2(填>,<或=)。
(4)根据实验,亚硫酸盐的性质有___________。盐溶液间反应的多样性与__________有关。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备乙酸乙酯的装置,如图所示,回答下列问题:
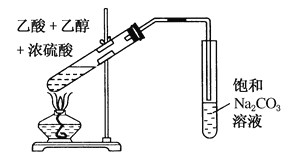
(1)乙醇、乙酸和浓硫酸混合时,应为_______________________________________。
(2)收集乙酸乙酯的试管内盛有的饱和碳酸钠溶液的作用是_________________________。
(3)反应中浓硫酸的作用是________________________________。
(4)反应中乙醇和乙酸的转化率不能达到100%,原因是__________________________。
(5)将收集到的乙酸乙酯分离出来的方法为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在压强为0.1 MPa、10L恒容的密闭容器中, 将2 mol CO与 5 mol H2的混合气体在催化剂作用下能生成甲醇:CO(g) + 2H2(g)![]() CH3OH(g) △H<0 请回答下列问题:
CH3OH(g) △H<0 请回答下列问题:
(1)①该反应的熵变ΔS__________0(填“>”、“<”或“=”)。
②若温度T1 >T2,则平衡常数K(T1)___________K(T2)(填“大于”、“小于”或“等于”)
③下列措施既可加快反应速率又可增加甲醇产率的是__________;
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入2 mol CO和5 mol H2
④下列可说明反应已达到化学平衡状态的是________;
A.v生成(CH3OH)=v消耗(CO) B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.CO与H2浓度比不再变化
(2)若温度T2时,5min后反应达到平衡,CO的转化率为75%,则:
①平衡时体系总的物质的量为________mol;
②反应的平衡常数K=______________;
③反应在0-5min区间的平均反应速率v(H2)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。

当V1=160mL时,则金属粉末中n(Mg)=________ mol,V2=_____________mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) _____________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
A | B | ||||||
D | E | F | |||||
C | G | H |
(1)上述元素的单质中熔点最高的可能是________________(填名称)。
(2)D的氢化物比G的氢化物稳定,其原因是__________________________________________________________。
(3)在一定条件下,A与E可形成一种极易溶于水的气态化合物,其电子式为___________;该物质溶于水后的溶液呈________性(填“酸”、“碱”或“中”)。
(4)现有另一种元素X,其原子获得一个电子所释放出的能量是上表中所列元素中最大的,则X是周期表中第__________族元素。
(5)“神舟”六号载人飞船内需要有一种化合物来吸收航天员呼出的CO2,你认为该物质应该是由上表中的___________(填字母代号)元素组成的,用化学方程式表示吸收原理_________________________________________________________________。
飞船中需要制造一种适合航天员生存的人工态环境,还应该在氧气中充入一种稀释气体,该气体化学式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com