
分析 Fe、Al合金粉末溶于足量盐酸中,加入过量NaOH溶液,沉淀为氢氧化铁,则经洗涤、干燥、灼烧,得到固体为氧化铁,氧化铁质量等于合金的质量,可知氧化铁中氧元素的质量等于合金中铝的质量,以此来解答.
解答 解:Fe、Al合金粉末溶于足量盐酸中,加入过量NaOH溶液,Al转化为NaAlO2,过滤得到的沉淀为Fe(OH)3,残渣充分灼烧发生2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,则所得固体质量与原合金质量质量相同,即Fe2O3质量等于合金的质量,可知Fe2O3中氧元素的质量等于合金中Al的质量,由氧化铁中质量关系可得合金中铁和铝的质量之比56×2:16×3=7:3,故答案为:7:3.
点评 本题考查混合物的计算,为高频考点,把握发生的反应及氧化铁中O元素质量与合金中Al的质量相同为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 ).下列分子中,与S8分子具有相同的几何构型的是( )
).下列分子中,与S8分子具有相同的几何构型的是( )| A. | SenS8-n | B. | (SNH)4 | C. | (NSH)4 | D. | S4N4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3与BF3,都是三角锥形 | |
| B. | NH3与BF3,都是极性分子 | |
| C. | NH3•BF3中各原子都达到8电子稳定结构 | |
| D. | NH3•BF3中,NH3提供孤电子对,BF3提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
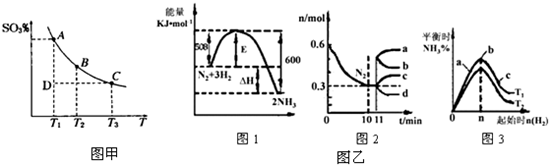
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
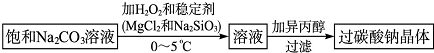
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com