
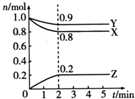
 某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.下列描述正确的是( )
某温度时,在一个2L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.下列描述正确的是( )| A. | 反应的化学方程式为2X(g)+Y(g)?2Z(g) | |
| B. | 反应开始到2min,X的物质的量浓度减少了0.4 mol•L-1 | |
| C. | 反应开始到2min,用Y表示的反应速率为0.1mol•L-1•min-1 | |
| D. | 反应到2min时,Z的物质的量浓度为0.2mol•L-1 |
分析 A.根据物质的量的变化,判断出反应物、生成物及是否是可逆反应,利用物质的量之比化学计量数之比书写方程式;
B.由图可知,2min内X的物质的量变化量为0.1mol/L;
C.由图可知,2min内Y的物质的量变化量为0.1mol,根据v=$\frac{\frac{△n}{V}}{t}$计算v(Z);
D.由图可知,反应到2min时,Z的物质的量浓度为0.1mol/L.
解答 解:A.由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.2mol:0.1mol:0.2mol=2:1:2,则反应的化学方程式为:2X+Y?2Z,故A正确;
B.由图可知,2min内X的物质的量变化量为0.1mol/L,故B错误;
C.由图可知,2min内Y的物质的量变化量为0.1mol,根据v=$\frac{\frac{△n}{V}}{t}$=$\frac{\frac{(1.0-0.9)mol}{2L}}{2min}$=0.025mol•L-1•min-1,故C错误;
D.由图可知,反应到2min时,Z的物质的量浓度为0.1mol/L,故D错误;故选A.
点评 本题考查化学反应速率的有关计算,难度不大,分析图象注意一看点:即起点、拐点、交点、终点;二看线:即看曲线的变化趋势和走向;三看面:即看清纵坐标、横坐标表示的物理量等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )
在不同条件下至少可能发生7种不同类型的有机反应,其中由于分子结构中含-OH而发生的反应有( )| A. | ①③④ | B. | ②③④⑤ | C. | ④⑤⑥⑦ | D. | ②③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 亚磷酸H3PO3只有Na2HPO3、NaH2PO3两种钠盐,所以亚磷酸没有正盐 | |
| B. | 同周期非金属元素的氧化物对应水化物的酸性从左到右依次增强 | |
| C. | 配位键也有方向性和饱和性 | |
| D. | H3PO4和H2CO3分子中非羟基氧的个数均为1,他们的酸性相近,均为中强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在单质中一定不存在离子键 | |
| B. | 非极性键只存在于双原子的单质分子(如Cl2)中 | |
| C. | 在离子化合物里,只存在离子键,没有共价键 | |
| D. | 化学键断裂一定伴随着化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应及实验目的 | 试剂X | 试剂Y |
| A | 电石与饱和食盐水混合, 检验乙炔气体 | CuSO4溶液 | 酸性KMnO4溶液 |
| B | 二氧化锰与浓盐酸混合加热, 验证氯、溴、碘单质氧化性依次减弱 | NaBr溶液 | KI溶液 |
| C | 乙醇与浓硫酸加热至170℃, 证明发生了消去反应 | NaOH溶液 | Br2的CCl4溶液 |
| D | 乙酸溶液与碳酸钠固体混合, 探究乙酸、碳酸和苯酚的酸性强弱 | 饱和NaHCO3溶液 | 苯酚钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )
是一种高效麻醉剂,该有机物同分异构体中含有羧基和氨基,且苯环上有2个取代基的有(不考虑立体异构)( )| A. | 18种 | B. | 15种 | C. | 13种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 mL 0.1 mol•L-1氨水与10 mL 0.1 mol•L-1盐酸混合,c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol•L-1NH4Cl溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol•L-1CH3COOH溶液与5 mL 0.2 mol•L-1NaOH溶液混合,c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol•L-1CH3COONa溶液与6 mL 1 mol•L-1盐酸混合,c(Cl-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
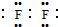 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com