
分析 根据C原子的价层电子对数判断杂化类型;单键中只有1个σ键,双键含有1个σ键和1个π键,三键中含1个σ键和、2个π键;乙炔加氢变成乙烯和乙烷,碳原子的杂化类型相应改变.
解答 解:乙烷、乙烯、乙炔中C原子的价层电子对数分别为4、3、2,则碳原子的杂化方式:sp3、sp2、sp;单键中只有1个σ键,双键含有1个σ键和1个π键,三键中含1个σ键和、2个π键;乙炔加氢变成乙烯和乙烷,碳原子的杂化轨道由sp杂化分别变成sp2杂化和sp3杂化.
答:碳原子的杂化方式分别为sp3、sp2、sp;单键中只有1个σ键,双键含有1个σ键和1个π键,三键中含1个σ键和、2个π键;碳原子的杂化轨道由sp杂化分别变成sp2杂化和sp3杂化.
点评 本题考查原子杂化方式及类型判断,题目难度不大,注意单键中只有1个σ键,双键含有1个σ键和1个π键,三键中含1个σ键和、2个π键.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:X>Z>W>Y | |
| B. | 氢化物的沸点高低顺序:Z>W | |
| C. | 元素非金属性强弱顺序:W>Z>Y | |
| D. | 化合物XW与XW2中化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离子方程式:H2CO3═2H++CO32- | |
| B. | 过量铁粉与稀硝酸反应:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 次氯酸钠溶液中滴入浓盐酸产生Cl2:2H++Cl-+ClO-═Cl2↑+H2O | |
| D. | (NH4)2Fe(SO4)2溶液中加入过量NaOH溶液并加热:NH4++Fe2++3OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+Fe(OH)2↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
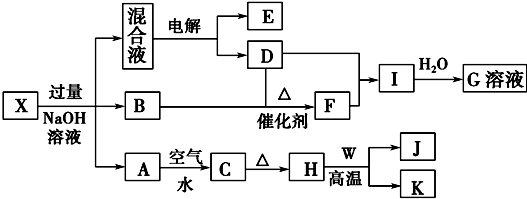
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 试管A | 试管B | |
| 加入试剂 | ||
| 实验现象(褪色时间) | ||
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度的盐酸反应速率快慢时,可以加K3[Fe(CN)6]沉淀,观察铁钉周围出现蓝色沉淀的快慢 | |
| B. | 探究温度对化学反应速率影响时,先将硫代硫酸钠与硫酸两种溶液混合后再用水浴加热 | |
| C. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(试纸)为:中和滴定实验、pH试纸 | |
| D. | 从海带中提取碘,可将灰化后的海带加入水中煮沸一段时间后过滤,向滤液中滴入几滴硫酸,再加入适量H2O2溶液氧化,最后加入CCl4萃取分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中碳原子不在一条直线上 | B. | 戊烷有三种同分异构体 | ||
| C. | 丙烷比丁烷更易液化 | D. | 新戊烷的沸点比正戊烷的沸点低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com