
分析 同周期自左而右元素的第一电离能呈增大趋势,但ⅡA族最外层为ns能级容纳2个电子,为全满确定状态,能量较低,第一电离能高于同周期相邻元素,ⅤA族np能级容纳3的电子,为半满稳定状态,能量较低,第一电离能也高于同周期相邻元素,同主族自上而下电离能降低,据此分析解答.
解答 解:(1)Li和Cs属于同一主族元素且原子序数依次增大,同一主族元素的第一电离能随着原子序数的增大而减小,所以其第一电离能大小顺序是:Li>Cs,
故答案为:Li;
(2)Li的s1为半满确定状态,能量较低,第一电离能高于同周期相邻元素,F不是其相邻元素,Li和F属于同一周期元素且原子序数依次增大,同一周期元素的第一电离能随着原子序数的增大而增大,所以其第一电离能大小顺序是:Li<F,
故答案为:F;
(3)Li和Cs属于同一主族元素,第一电离能大小顺序是:Li>Cs,Li和F属于同一周期元素,第一电离能大小顺序是:Li<F,所以Cs和F第一电离能大小顺序是:Cs<F,
故答案为:F;
(4)F和I属于同一主族元素且原子序数依次增大,同一主族元素的第一电离能随着原子序数的增大而减小,所以其第一电离能大小顺序是:F>I,
故答案为:F.
点评 本题考查同主族、同周期元素电离能的比较,为高频考点,把握同周期元素的性质变化规律,半满、全满等为解答的关键,侧重分析与应用能力的考查,注意半满为稳定结构难失去电子,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 任何分子或化合物都是通过原子间形成化学键相结合的 | |
| B. | 物质发生化学反应时,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 分子的稳定性与化学键强弱有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| B. | 加水,平衡向逆反应方向移动 | |
| C. | 滴加少量0.1mol/LHCl溶液,溶液中C(H+ )减少 | |
| D. | 加入少量CH3 C OONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往溶液中滴入0.2 mol•L-1的氨水 | B. | 往溶液中加入NH4Cl晶体 | ||
| C. | 往溶液中加入CH3COONa固体 | D. | 往溶液中加入NaOH固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
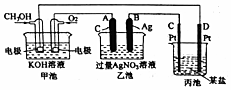
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 、
、 、
、 ;属于芳香醚类的是C6H5OCH3.
;属于芳香醚类的是C6H5OCH3. 、
、 或
或 (写两种);
(写两种);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液的pH等于13 | |
| B. | 加入少量NH4Cl固体,c(OH-)不变 | |
| C. | c(OH-)=c(NH4+)+c(H+) | |
| D. | 与1.0 mL 0.l mol/L盐酸混合后,溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a=1时,发生的离子反应为:OH-+H+═H2O | |
| B. | 当a=2时,发生的离子反应为:OH-+CO32-+2H+═HCO3-+H2O | |
| C. | 当1<a<2,反应后的溶液中CO32-和HCO3-的物质的量之比为:(a×10-2-0.01):(0.02-a×10-2) | |
| D. | 当a≥3时,发生的离子反应:3H++OHˉ+CO32-═2H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com