
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.9kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-241.8kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=+285.9kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+241.8kJ/mol |
分析 据热化学方程式的书写原则写出氢气燃烧生成气态水的热化学方程式,方程中的热量和化学计量数要对应,根据1mol气态水转化成液态水放出的热量,结合氢气与氧气反应生成气态水的反应热计算生成液态水的反应热.
解答 解:氢气和氧气反应生成1mol水蒸气放热241.8kJ,该反应的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol,1g水蒸气转化为液态水放出2.45kJ的热量,1mol气体水变成液体水时要放出44.1kJ的热量,故反应H2(g)+$\frac{1}{2}$O2(g)=H2O(l)的反应热△H=-(241.8kJ/mol+44.1kJ/mol)=-285.9kJ/mol;
故选A.
点评 本题考查了热化学方程式的书写与反应热的计算、燃烧热等,难度不大,注意掌握热化学方程式的书写.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 清晨,在茂密的树林,常常可以看到从枝叶间透过的一道道光柱 | |
| B. | 一支钢笔使用两种不同牌号的蓝黑墨水,易出现堵塞 | |
| C. | 在饱和FeCl3溶液中逐滴加入NaOH溶液,产生红褐色沉淀 | |
| D. | 在河水与海水交界处有三角洲形成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | Na2O2与 H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 氯气与水反应:Cl2+H2O═Cl-+2H++ClO- | |
| D. | 碳酸镁与稀盐酸反应:MgCO3+2H+═Mg2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢原子的结构示意图为: ;则反氢原子的结构示意图为: ;则反氢原子的结构示意图为: | |
| B. | 反氢原子中有一个带负电荷的反质子和一个带正电荷的反电子 | |
| C. | 反氢原子的摩尔质量为1g/mol | |
| D. | 21H的反氢原子中有2个带负电荷的反质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中有少量蒸馏水 | |
| B. | 溶液从烧杯转移到容量瓶后没有洗涤烧杯 | |
| C. | 未冷却即将溶液转移到容量瓶 | |
| D. | 定容时俯视容量瓶刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
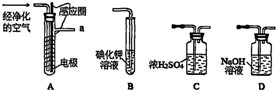
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
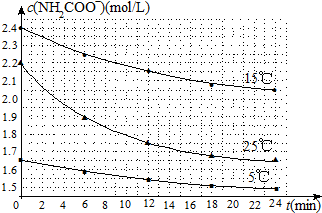
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
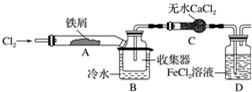 FeCl3在现代工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
FeCl3在现代工业生产中应用广泛,某化学研究性学习小组模拟工业流程制备无水FeCl3.经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com