
【题目】氮元素是地球大气中含量最多的元素,请完成下列有关问题
(1)写出氮元素的原子结构示意图:_____________。
(2)将空气中的氮气转化为氮的化合物的过程称为固氮。下列能实现固氮的是_______
A.N2和H2在一定条件下反应生成NH3
B.雷雨闪电时空气中的N2和O2化合生成NO
C.NH3经过催化氧化生成NO
D.NH3和HNO3反应生成NH4NO3
(3)写出实验室制取氨气的化学反应方程式_______________。
(4)如图是实验室制取氨气的装置,请指出图中错误之处:______________。

(5)用如图装置进行喷泉实验,挤压滴管的胶头时,现象_________。

(6)若实验室要收集一定量的氨气应用什么方法收集:____________。
(7)请写出氨气的催化氧化反应方程式:_______________。
【答案】![]() AB Ca(OH)2+2NH4Cl
AB Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O 试管口应向下倾斜 产生蓝色的喷泉 向下排空气法 4NH3+5O2
CaCl2+2NH3↑+2H2O 试管口应向下倾斜 产生蓝色的喷泉 向下排空气法 4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
【解析】
(1)氮原子的核外有7个电子,根据核外电子排布书写氮原子结构示意图;
(2)氮的固定是将空气中的氮气转化为氮的化合物的过程,根据固氮原理回答;
(3)消石灰和氯化铵固体混合加热产生氨气、氯化钙和水,完成化学方程式;
(4)固体加热制气体时,试管口应略向下倾斜;
(5)利用氨气极易溶于水,形成压强差而形成喷泉,氨水呈碱性,使石蕊试液变为蓝色;
(6)氨气极易溶于水,只能用排空气法收集,再利用氨气的密度小于空气的密度选择合适的收集方法;
(7)氨气的催化氧化会生成一氧化氮和水,写出化学方程式;
(1)N原子核外有7个电子,核外电子排布是2、5,则N原子结构示意图为:![]() ;
;
(2)将空气中的氮气转化为氮的化合物的过程称为固氮。
A.N2和H2在一定条件下反应生成NH3,氮元素的单质变为化合物,属于人工固氮,故A正确;
B.雷雨闪电时空气中的N2和O2化合生成NO,氮元素的单质变为化合物,属于氮的固定,是自然固氮,故B正确;
C.NH3经过催化氧化生成NO,是N元素的化合物的转化,不是氮的固定,故C错误;
D.NH3和HNO3反应生成NH4NO3,是N元素的化合物的转化,不是氮的固定,故D错误;
答案选AB。
(3)消石灰与氯化铵固体混合加热产生氨气、氯化钙和水,此反应的化学方程式为:Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O;
CaCl2+2NH3↑+2H2O;
(4)加热制气体时,试管口应略向下倾斜;防止产生的水流入试管底部,引起试管炸裂;
(5)利用氨气极易溶于水,形成压强差而形成喷泉,氨水呈碱性,使石蕊试液变为蓝色;
(6)氨气极易溶于水,只能用排空气法收集,再利用氨气的密度小于空气的密度,选择向下排空气法收集;
(7)氨气的催化氧化生成一氧化氮和水,化学方程式为:4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。


科目:高中化学 来源: 题型:
【题目】科学家一直致力于“人工固氮”的研究,现已有多种方法。
(方法一)1918年,德国化学家哈伯因发明工业合成氨(N2(g)+3H2(g)![]() 2NH3(g) H<0)的方法而荣获诺贝尔化学奖。
2NH3(g) H<0)的方法而荣获诺贝尔化学奖。
(1)若将1molN2和3molH2放入1L的密闭容器中,5min后N2的浓度为0.8mol/L,这段时间内用N2的浓度变化表示的反应速率为_____mol/(L·min)。
(2)在一定温度下的定容密闭容器中发生上述反应,下列叙述能说明反应已经达到平衡状态的是____。
a. v(N2)正=3v(H2)逆
b. 容器中气体的密度不随时间而变化
c. 容器中气体的分子总数不随时间而变化
d. 容器中气体的平均相对分子质量不随时间而变化
(3)合成氨反应的生产条件选择中,能用勒夏特列原理解释的是________。
①使用催化剂 ②高温 ③高压 ④及时将氨气液化从体系中分离出来
A. ①③ B. ②③ C. ③④ D. ②④
(方法二)1998年,两位希腊化学家提出了电解合成氨的新思路:
(4)采用高质子导电性的SCY陶瓷(能传递H+)为介质,实现了高温(570℃)常压下高转化率的电解法合成氨,转化率可达到78%,装置如下图:
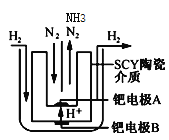
钯电极A是电解池的___极(填“阳”或“阴”),阳极反应式为________。
(方法三)最新的“人工固氮”研究报道:在常温、常压、光照条件下,N2在催化剂表面与水发生反应,直接生成氨气和氧气:
已知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
2H2(g)+O2(g)=2H2O(1) △H=-571.6 kJ/mol
(5)写出上述固氮反应的热化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列属于吸热反应的是________;属于放热反应的是________。
①煅烧石灰石 ②木炭燃烧 ③酸碱中和 ④二氧化碳和碳高温反应
(2)![]() 熔点较低,易升华,溶于醇和醚,其与
熔点较低,易升华,溶于醇和醚,其与![]() 化学性质相似。由此可推断
化学性质相似。由此可推断![]() 的化学键是________(填“离子键”或“共价键”),其在固态时属于________(填“原子”、“分子”或“离子”)晶体。
的化学键是________(填“离子键”或“共价键”),其在固态时属于________(填“原子”、“分子”或“离子”)晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择装置,完成实验。
|
|
|
|
① | ② | ③ | ④ |
(1)分离水和植物油,选用___(填序号,下同)。
(2)配制100mL0.1mol·L-1NaOH溶液,选用___。
(3)鉴别Na2CO3和NaHCO3固体,选用__。
(4)用乙酸、乙醇和浓硫酸制备乙酸乙酯,选用__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α-溴代羰基化合物合成大位阻醚的有效方法可用于药物化学和化学生物学领域。用此法合成化合物J的路线如下:

已知:
回答下列问题:
(1)F中含有的含氧官能团的名称是______,用系统命名法命名A的名称是______。
(2)B→ C所需试剂和反应条件为___________。
(3)由C生成D的化学反应方程式是__________。
(4)写出G的结构简式_________,写出检验某溶液中存在G的一种化学方法________。
(5)F+H→J的反应类型是_______。F与C在CuBr和磷配体催化作用下也可合成大位阻醚,写出其中一种有机产物的结构简式:_______。
(6)化合物X是E的同分异构体,分子中不含羧基,既能发生水解反应,又能与金属钠反应。符合上述条件的X的同分异构体有_______种(不考虑立体异构),其中能发生银镜反应,核磁共振氢谱有3组峰,峰面积之比为1:1:6的结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,AgCl(s)=Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A. 加入AgNO3可以使溶液由c点变到d点
B. 加入固体NaCl,则AgCl的溶解度减小,Ksp也减小
C. d点有AgCl沉淀生成
D. a点对应的Ksp小于b点对应的Ksp
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生的绿色能源,CO2是一种温室气体,都是重要的化工原料。
(1)已知CO的燃烧热△H为-283kJ·mol-1,CO(g)+2H2(g)![]() CH3OH(l) △H=-129kJ·mol-1,欲求出CH3OH的燃烧热.则需要知道一个反应,该反应的热化学方程式为___。(无需写出△H的具体数值)
CH3OH(l) △H=-129kJ·mol-1,欲求出CH3OH的燃烧热.则需要知道一个反应,该反应的热化学方程式为___。(无需写出△H的具体数值)
(2)向温度不同容积均为1 L的a、b、c、d、e五个恒容密闭容器中各充入3molCO2、7molH2的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=Q kJ·mol-1,反应过程中维持各容器温度不变,测得t1时刻各密器中H2O的体积分数(H2O)如图所示。
CH3OH(g)+H2O(g) △H=Q kJ·mol-1,反应过程中维持各容器温度不变,测得t1时刻各密器中H2O的体积分数(H2O)如图所示。

①Q___(填“>”或“<”)0,五个容器中肯定处于非平衡状态的是___。
②t2时刻时,容器b中正反应速率__(填“大于”“小于”或“等于”)容器e中正反应速率;
③Td℃时,该反应的平衡常数K=__;
(3)碳捕捉技术的应用既可降低碳排放也可得到重要的化工产品。
①NaOH溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(HCO3-):c(CO32-)=2:1,则所得溶液的pH=___[常温下Kl(H2CO3)=4.4×10-7、K2(HCO3-)=5×10-11]。
②在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3,将微溶的CaSO4难溶性的CaCO3的理由是___。
(4)用甲醇作为燃料电池的原料,请写出在碱性介质中电池负极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①⑤五种元素在周期表中的位置:

请按要求回答下列问题:
(1)元素④的原子结构示意图为______.
(2)元素①单质的电子式为______.
(3)元素②⑤的原子半径由大到小的顺序为(填元素符号)______,它们的最高价氧化物对应的水化物中,酸性最强的是______(填化学式).
(4)元素②的单质在氧气中燃烧的产物与二氧化碳反应的化学方程式为______;元素③的最高价氧化物与烧碱溶液反应的离子方程式为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com