
| A. | 1.0mol/L NH4HCO3溶液pH=8.0.由此可知Ka1(H2CO3)>Kb(NH3•H2O)>Ka2(H2CO3) | |
| B. | 向氨水中加入NH4C1固体,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$增大 | |
| C. | 向CH3COONa溶液中滴加硫酸至中性时,c(SO42ˉ)<c(CH3COOH) | |
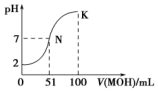
| D. | 图中曲线可以表示向100mL 0.01 mol/LCH3COOH溶液中逐滴加入0.02mol/L NaOH溶液的pH变化情况(溶液体积变化忽略不计) |
分析 A.1.0mol/L NH4HCO3溶液pH=8.0,说明碳酸氢根离子的水解程度大于铵根离子水解程度;
B.铵根离子的水解常数为Kh=$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$,水解常数只与温度有关;
C.向CH3COONa溶液中滴加硫酸至中性时,溶液中电荷守恒为:c(CH3COO-)+2c(SO42-)+c(OH-)=c(Na+)+c(H+),结合物料守恒分析;
D.0.01 mol/LCH3COOH溶液中pH大于2.
解答 解:A.1.0mol/L NH4HCO3溶液pH=8.0,说明碳酸氢根离子的水解程度大于铵根离子水解程度,水解程度越大,对应弱电解质的电离常数越小,则Ka1(H2CO3)>Ka2(H2CO3)>Kb(NH3•H2O),故A错误;
B.铵根离子的水解常数为Kh=$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$,水解常数只与温度有关,所以向氨水中加入NH4C1固体,溶液中$\frac{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}{c(N{H}_{4}^{+})}$不变,故B错误;
C.向CH3COONa溶液中滴加硫酸至中性时,c(OH-)=c(H+),溶液中电荷守恒为:c(CH3COO-)+2c(SO42-)+c(OH-)=c(Na+)+c(H+),则c(CH3COO-)+2c(SO42-)=c(Na+),溶液中物料守恒为c(CH3COO-)+c(CH3COOH)=c(Na+),所以c(SO42ˉ)<c(CH3COOH),故C正确;
D.CH3COOH是弱酸在溶液中部分电离,则0.01 mol/LCH3COOH溶液中pH大于2,图中滴定前溶液中pH=2,不符合,故D错误.
故选C.
点评 本题考查了溶液中离子浓度大小比较、盐的水解原理、弱电解质的电离平衡常数的计算等知识,题目难度中等,注意掌握盐的水解原理及其应用方法,明确电离平衡常数的概念及计算方法,试题培养了学生灵活应用所学知识的能力及化学计算能力.


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | NaHCO3的电离方程式:NaHCO3═Na++H++CO32- | |
| C. | Fe与盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Ba(OH)2和CuSO4溶液反应:Cu2++SO42-+Ba2++2OH-═BaSO4↓+Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热交换器 | B. | 沸腾炉 | C. | 吸收塔 | D. | 接触室 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com