
分析 (1)实验室用浓盐酸和二氧化锰在加热条件下制取氯气;
(2)已知CH4、H2和CO的燃烧热分别为890.3kJ•mol-1、285.8kJ•mol-1、283.0kJ•mol-1,热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
依据盖斯定律①-②×2-③×2得到:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247kJ/mol,
根据CO和反应热之间的关系式计算;
(3)氯仿和双氧水反应生成HCl、水和光气;
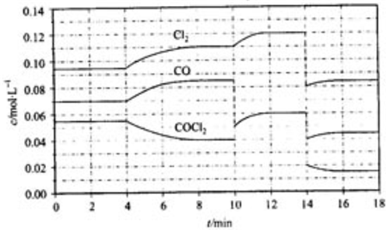
(4)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,代入平衡常数表达式K=$\frac{c(CO).c(C{l}_{2})}{c(COC{l}_{2})}$计算;
②第8min时反应物的浓度比第2min时减小,生成物浓度增大,平衡向正反应方向移动,4min瞬间浓度不变,不可能为改变压强、浓度,应是改变温度,结合温度对平衡影响判断;
③由图可知,10min瞬间Cl2浓度不变,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,根据平衡常数计算c(COCl2);
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0;
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小.
解答 解:(1)实验室用浓盐酸和二氧化锰在加热条件下制取氯气,反应方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)已知CH4、H2和CO的燃烧热分别为890.3kJ•mol-1、285.8kJ•mol-1、283.0kJ•mol-1,热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ•mol-1
③CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ•mol-1
依据盖斯定律①-②×2-③×2得到:CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=+247kJ/mol,
生成1m3(标准状况)CO物质的量=$\frac{1000L}{22.4L/mol}$,所需热量=$\frac{\frac{1000L}{22.4L/mol}×347kJ}{2mol}$=5.52×103kJ
故答案为:5.52×103kJ;
(3)氯仿和双氧水反应生成HCl、水和光气,反应方程式为CHCl3+H2O2=HCl+H2O+COCl2,
故答案为:CHCl3+H2O2=HCl+H2O+COCl2;
(4)①由图可知,8min时COCl2的平衡浓度为0.04mol/L,Cl2的平衡浓度为0.11mol/L,CO的平衡浓度为0.085mol/L,K=$\frac{c(CO).c(C{l}_{2})}{c(COC{l}_{2})}$=$\frac{0.085×0.11}{0.04}$=0.234mol/L,故答案为:0.234mol/L;
②由第2min反应温度变为第8min反应温度时,生成物浓度增大、反应物浓度减小,平衡向正反应方向移动,正反应是吸热反应,升高温度,平衡向正反应方向移动,所以T(2)<T(8),
故答案为:<;
③由图可知,10min瞬间Cl2浓度增大,CO的浓度降低,故改变条件为移走CO,降低CO的浓度,平衡常数不变,与8min到达平衡时的平衡常数相同,由图可知,12min时到达平衡时Cl2的平衡浓度为0.12mol/L,CO的平衡浓度为0.06mol/L,故:$\frac{0.06×0.12}{c(COC{l}_{2})}$=0.234mol/L,解得c(COCl2)=0.031mol/L;
故答案为:0.031;
④根据化学反应速率的定义,可知反应在2~3 min和12~13 min处于平衡状态,CO的平均反应速率为0,在5~6min时,反应向正反应进行,故CO的平均反应速率为:v(5~6)>v(2~3)=v(12~13),
故答案为:v(5~6)>v(2~3)=v(12~13);
⑤在5~6 min和15~16 min时反应温度相同,在相同温度时,该反应的反应物浓度越高,反应速率越大,但15~16 min时各组分的浓度都小,因此反应速率小,即v(5~6)>v(15~16),
故答案为:>;在相同温度时,该反应的反应物浓度越高,反应速率越大.
点评 本题考查化学平衡计算、盖斯定律等知识点,为高频考点,明确外界条件对化学平衡影响、图中曲线含义及变化产生的原因等知识点是解本题关键,温度不变化学平衡常数不变,化学平衡常数与各物质浓度无关,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | VL该气体的质量(以g为单位) | B. | 1L该气体中所含的分子数 | ||
| C. | 1mol该气体的体积(以L为单位) | D. | 1L该气体的质量(以g为单位) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| A13+ | 3.8 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将铁片换成铁粉 | B. | 把稀硫酸换成浓硫酸 | ||
| C. | 加热 | D. | 加入少量CuO粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 该反应是放热反应,降低温度正反应速率加快 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硼和氮元素在化学中有很重要的地位,回答下列问题:
硼和氮元素在化学中有很重要的地位,回答下列问题: .预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.
.预计于2017年发射的“嫦娥五号”探测器采用的长征5号运载火箭燃料为偏二甲肼[(CH3)2NNH2].(CH3)2NNH2中N原子的杂化方式为sp3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16g14CH4所含中子数目为8NA | |
| B. | 标准状况下,7.8g苯中含碳碳双键的数目为0.3NA | |
| C. | 含0.2NA个阴离子的Na2O2和水完全反应转移0.2mol电子 | |
| D. | 5.6g铁粉在足量的氯气中充分燃烧,得到电子数为0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com