
| A. | Na2O2、CaCl2 | B. | CO2、CH4 | C. | NH4Cl、NaOH | D. | NaF、HNO3 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,第IA族(H元素除外)、第IIA族和第VIA族、第VIIA族元素之间易形成离子键,据此分析解答.
解答 解:A.过氧化钠中钠离子和过氧根离子之间存在离子键、O-O原子之间存在共价键,氯化钙中钙离子和氯离子之间中存在离子键,故A错误;
B.二氧化碳分子中C-O原子之间只存在共价键,甲烷分子中C-H原子之间只存在共价键,故B错误;
C.氯化铵中铵根离子和氯离子之间存在离子键、N-H原子之间存在共价键,NaOH中钠离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故C正确;
C.NaF中钠离子和氟离子之间只存在离子键,硝酸中H-O、N-O原子之间只存在共价键,故D错误;
故选C.
点评 本题考查化学键判断,为高频考点,侧重考查学生分析判断能力,明确离子键构成微粒及微粒之间作用力是解本题关键,注意铵盐中不含金属元素但含有离子键,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 说明乙醇分子中含有氢原子 | |
| B. | 说明乙醇分子中含有氧原子 | |
| C. | 说明乙醇分子中含有氢离子 | |
| D. | 说明乙醇分子中含有不同于烃分子里的氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
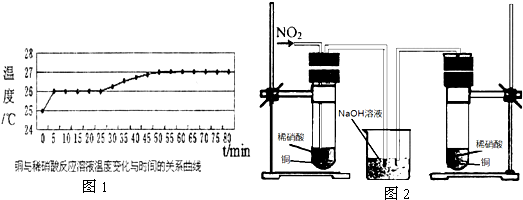
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 | |
| B. | 浓硫酸具有脱水性,可用于干燥氯气 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铝熔点很高,可用于制耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
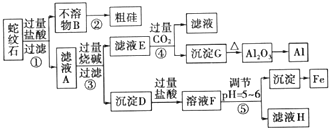
| 金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Mg2+ | 9.4 | 11.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 2.8gN2和CO的混合气体中所含质子数为1.4NA | |
| C. | 235g${\;}_{92}^{235}$U发生裂变反应${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为9NA | |
| D. | 50mL12mol/L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 成语、谚语、俗语 | 理解或寓意 |
| A | “甘之如饴” | 糖类均有甜味 |
| B | “冰、水为之,而寒于水” | 相同质量和温度的水和冰,冰的能量高 |
| C | “雷雨肥庄稼” | 农作物生长需要水,雷雨天提供了大量的雨水 |
| D | “春蚕到死丝方尽” | 蚕丝的只要成分是蛋白质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠 | B. | 氢氧化铝 | C. | 碳酸镁 | D. | 硫酸钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com