
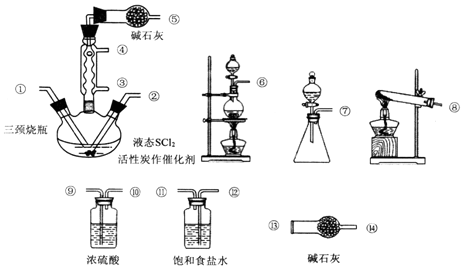
分析 实验室用二氧化锰与浓盐酸制取氯气:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,制备的氯气中混有HCl和水蒸气,用饱和食盐水吸收HCl,用浓硫酸干燥氯气,二氧化硫气体由亚硫酸钠和浓硫酸制备,同理用浓硫酸干燥制得的二氧化硫气体,干燥纯净的氯气和二氧化硫在三颈烧瓶中反应制得SOCl2,SO2+C12+SCl2=2SOCl2,SOCl2易水解,氯气和二氧化硫污染空气,不能直接排放,故冷凝管上连接的盛有碱石灰的干燥管,实验结束后,将三颈烧瓶中混合物蒸馏得到产品,据此分析作答.
解答 解:(1)二氧化锰与浓盐酸制备氯气,固液加热型,故为⑥,饱和食盐水吸收HCl,用浓硫酸干燥氯气,二氧化硫气体由亚硫酸钠和浓硫酸制备,用⑦,同理用浓硫酸干燥制得的二氧化硫气体,干燥纯净的氯气和二氧化硫在三颈烧瓶中反应制得SOCl2,除杂干燥为充分,导气管应长进短出,则连接顺序为:⑥→⑫→⑪→⑨→⑩→①②←⑩←⑨←⑦;
故答案为:⑫→⑪→⑨→⑩;⑩←⑨←⑦;
(2)采用逆流发,故冷凝管口③为进水口;干燥管的作用是吸收逸出的Cl2、SO2,防止空气中的水蒸气进入反应装置而使SOCl2水解;
故答案为:进水;吸收逸出的Cl2、SO2,防止空气中的水蒸气进入反应装置而使SOCl2水解;
(3)实验室用二氧化锰与浓盐酸制备氯气,离子反应为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;根据题意SOCl2与水反应产生白雾,并带有刺激性气味的气体产生,说明生成HCl和二氧化硫,故反应为:SOCl2+H2O=SO2↑+2HCl↑;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;SOCl2+H2O=SO2↑+2HCl↑;
(4)已知氯化亚砜沸点为77℃,SCl2的沸点为50℃,所以采用分馏的方法即可将之分离;消耗氯气为$\frac{0.896L}{22.4L/mol}$=0.04mol,由SO2+Cl2+SCl2═2SOCl2,生成0.08molSOCl2,则SOCl2的产率为$\frac{6.76g}{0.08mol×119g/mol}$×100%=71%;
故答案为:蒸馏;71%;
(5)取少量的SOCl2加入足量NaOH溶液,振荡、静止得到无色溶液,含亚硫酸根离子和氯离子,检验溶液存在的Cl-的方法是取少量溶液于试管中,加入过量Ba(NO3)2溶液,静置,取上层清液,滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl-;
故答案为:取少量溶液于试管中,加入过量Ba(NO3)2溶液,静置,取上层清液,滴加HNO3酸化,再加入AgNO3溶液,产生白色沉淀,则说明溶液中有Cl-.
点评 本题考查物质的制备实验,为高考常见题型,把握制备实验及发生的反应为解答的关键,侧重于学生的分析能力和实验能力的考查,注意常见气体的制备原理及应用,题目难度中等.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:选择题
| A. | 石英坩埚耐高温,可用来加热熔化NaOH固体 | |
| B. | 二氧化硫具有强氧化性,可用于漂白纸张 | |
| C. | 铝能置换出氧化铁中的铁,工业上利用铝热反应冶炼铁 | |
| D. | 医用酒精能使蛋白质变性,可用来消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度(℃) | |||
| 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 该反应的逆反应为放热反应 | |
| B. | 达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小 | |
| C. | 达到平衡时,容器Ⅰ中的压强与容器Ⅲ中的压强相同 | |
| D. | 若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol 和H2O 0.10 mol,则反应将向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800℃ | c3 | 0.92 | 0.75 | 0.60 | 0.60 | 0.60 | 0.60 |
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示的装置在实验室中用途比较广泛:
如图所示的装置在实验室中用途比较广泛:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
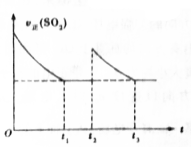 一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.测得v正(SO2)随反应时间(t)的变化如图所示.下列有关说法正确的是( )
一定温度下,密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)△H<0.测得v正(SO2)随反应时间(t)的变化如图所示.下列有关说法正确的是( )| A. | t2时改变的条件是:只加入一定量的SO2 | |
| B. | t1时平衡常数K1大于t3时平衡常数K2 | |
| C. | t1时平衡混合气的$\overline{{M}_{1}}$大于t3时平衡混合气的$\overline{{M}_{2}}$ | |
| D. | t1时平衡混合气中的SO3的体积分数等于t3时平衡混合气中SO3的体积分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
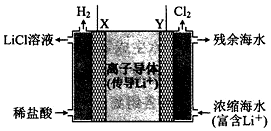 浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )
浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )| A. | 电池工作时,Li+通过离子电子导体移向b区 | |
| B. | 电流由X极通过外电路移向Y极 | |
| C. | 正极发生的反应为:2H++2e-=H2↑ | |
| D. | Y极每生成1 mol Cl2,a区得到2 mol LiCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ③④⑤ | C. | ⑤⑦⑧ | D. | 只有③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com