
有些科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列有关硅的说法中,不正确的是
A. 高纯度的硅广泛用于制作计算机
B. 硅可由二氧化硅还原制得
C. 低温时,硅与水、空气和酸不反应,但能与氢氟酸反应
D. 自然界中硅的储量丰富,自然界中存在大量的单质硅
科目:高中化学 来源: 题型:
某校化学实验兴趣小组欲采用如图所示的实验装置制
Cl2,同时进行与氯气有关的某些实验,按要求回答问题。
(1) 药品A的名称是 ,此反应的离子方程
式是 。
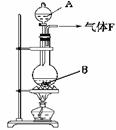 (2)甲同学用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下) 1.12 L(填“大于”“等于”“ 小于”)。
(2)甲同学用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制Cl2,结果制得的Cl2体积(标准状况下) 1.12 L(填“大于”“等于”“ 小于”)。
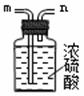
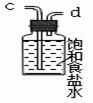
(3)在实验室中,乙同学欲用下图中的装置净化氯气,则气流方向是:
气体F→ → → → (填代号)。
(4)把净化后的氯气通入如下(图一)装置。① 观察到a不褪色,b褪色, 可
得到的结论是: ;② 检验吸收Cl2后的NaOH溶液中含有Cl-时,需要滴加的试剂以及现象为 。
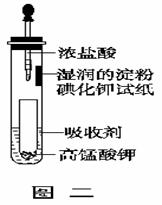
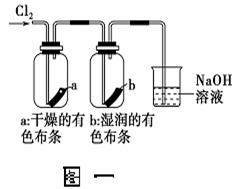
(5)一位同学设计了一套用浓盐酸和KMnO4固体制取少量氯气并比较氯气与碘单质的氧化性强弱的微型装置(如上图二)。能说明Cl2的氧化性强于I2的实验现象是 : 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有一包白色固体,可能含有K2CO3、Na2SO4、KCl、CuSO4中的一种或几种。为探究其成分,张华同学进行了如下实验:
(1)取少量白色固体于试管中加水溶解,得到无色澄清溶液,因此他认为肯定有一种物质不存在,这种物质的化学式为__________,推断的依据是________________________________________ ________________________________。
(2)接着又向试管中加入稍过量的BaCl2溶液和稀HNO3,观察到先有白色沉淀生成,而后白色沉淀部分溶解并产生无色气泡。因此他认为肯定存在两种物质,它们的名称是________________________________________________________________________________,推断的依据是________________________ __________。
(3)将所得到的混合物过滤,取滤液少量于另一洁净的试管中,加入稍过量的AgNO3溶液和稀HNO3,结果也得到了白色沉淀。因此他认为原白色固体中肯定存在KCl。你认为他的结论________(填“对”或“不对”),理由是________________________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关钠的叙述正确的是( )
A.2.3 g钠与97.7 g水反应后溶液中溶质的质量分数等于4%
B.钠跟CuSO4溶液反应生成的蓝色沉淀上有时出现暗斑,这是析出了金属铜
C.将金属钠与水反应后的溶液中通入适量氯气后,溶液中含有两种溶质
D.钠在空气中的缓慢氧化与其在空气中点燃的产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室也可用KMnO4固体和浓盐酸反应制氯气,反应方程式如下:2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑。回答下列问题:
(1)该反应中氧化剂是__________,还原产物是____________。
(2)若参加反应的高锰酸钾为7.9 g,被氧化的HCl的物质的量是多少?把生成的氯气全部通入足量氢氧化钠溶液中,生成次氯酸钠多少克?
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
①氯气的性质活泼,它与氢气混合后立即发生爆炸
②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收
③新制氯水的氧化性强于久置氯水
④检验HCl气体中是否混有Cl2方法是将气体通入硝酸银溶液
⑤除去HCl气体中的Cl2可将气体通入饱和食盐水
A.①②③ B.②③④ C.③ D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
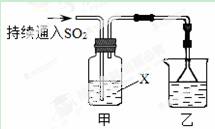 某化学兴趣小组用以下装置探究SO2的某些化学性质。
某化学兴趣小组用以下装置探究SO2的某些化学性质。
(1)装置乙的作用是 。
(2)若X为品红溶液,观察到溶液褪色,说明SO2具有 (填序号,下同);若X为Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
a.氧化性 b.还原性 c.漂白性
(3)若试剂X为Ca(ClO)2溶液,可观察到白色沉淀生成,完成该过程的离子方程式:
 Ca2++
Ca2++ ClO-+
ClO-+ SO2+
SO2+ H2O=
H2O= ↓+
↓+ Cl-+
Cl-+ SO42-+
SO42-+ 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
①CaCO3(s)===CaO+CO2(g) ΔH=177.7 kJ
②C(s)+H2O(s)===CO(g)+H2(g)
ΔH=-131.3 kJ/mol
③H2SO4(l)+NaOH(l)===Na2SO4(l)+H2O(l)
ΔH=-57.3 kJ/mol
④C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
⑤CO(g)+O2(g)===CO2(g) ΔH=-283 kJ/mol
⑥HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l)
ΔH=-57.3 kJ/mol
⑦2H2(g)+O2(g)===2H2O(l) ΔH=-517.6 kJ/mol
(1)上述热化学方程式中,不正确的有________,不正确的理由分别是_______________________________________________________________。
(2)根据上述信息,写出C转化为CO的热化学方程式_____________。
(3)上述反应中,表示燃烧热的热化学方程式有________________;表示中和热的热化学方程式有________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
不能用于判断金属失电子能力强弱的是
A.同主族金属元素原子半径大小
B.1 mol金属单质在反应中失去电子的多少
C.水溶液中金属间发生的置换反应
D.金属元素最高价氧化物对应水化物的碱性强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com