
室温时,下列混合溶液的pH一定小于7的是
A.pH=3的盐酸和pH=11的氨水等体积混合
B.pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合
C.pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合
D.pH=3的硫酸和pH=11的氨水等体积混合
C
【解析】
试题分析:A.盐酸是强酸,完全电离,pH=3的盐酸c(HCl)=c(H+)=10-3mol/L;一水合氨是弱碱,部分电离,溶液的pH=11,c(OH-)=10-3mol/L,所以c(NH3?H2O)> 10-3mol/L, 等体积混合时,NH3?H2O电离的部分恰好完全中和,过量的一水合氨会继续电离产生OH-,因此混合溶液的pH一定大于7,错误;B.盐酸是强酸,氢氧化钡是强碱,完全电离,所以pH=3的盐酸和pH=11的氢氧化钡溶液等体积混合,二者恰好完全反应产生水,所以溶液的pH=7,错误;C.醋酸是弱酸,部分电离,氢氧化钡是强碱,完全电离,所以pH=3的醋酸和pH=11的氢氧化钡溶液等体积混合,酸电离产生的H+与OH-恰好完全反应,未电离的酸分子会继续电离产生H+,因此混合溶液显酸性,pH<7,正确;D.硫酸是强酸,去电离,一水合氨是弱碱,部分电离,所以pH=3的硫酸和pH=11的氨水等体积混合,NH3?H2O电离的部分恰好完全中和,过量的一水合氨会继续电离产生OH-,因此混合溶液的pH一定大于7,错误。
考点:考查酸与碱溶液等体积混合时溶液酸碱性的计算的知识。


科目:高中化学 来源:2014~2015江苏省高一上学期期中化学试卷(解析版) 题型:选择题
某物质灼烧时,焰色为黄色,下列判断中正确的是
A.该物质一定是钠的化合物
B.该物质一定含钠元素
C.能确定该物质中一定不含钾元素
D.该物质一定是金属钠
查看答案和解析>>
科目:高中化学 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:填空题
(8分)已知在25 ℃时,醋酸、次氯酸、碳酸和亚硫酸的电离平衡常数分别为
醋酸 K=1.75×10-5 次氯酸 K=2.95×10-8
碳酸K1=4.30×10-7 K2=5.61×10-11 亚硫酸 K1=1.54×10-2 K2=1.02×10-7
(1)写出碳酸的第一级电离平衡常数表达式K1=__________。
(2)在相同条件下,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中碱性最强的是________。等浓度的Na2CO3和NaHCO3的混合溶液中各离子浓度大小顺序为 。
(3)若保持温度不变,在醋酸溶液中通入少量HCl,下列量会变小的是________。
a.c(CH3COO-) b.c(H+) c.醋酸的电离平衡常数
(4)下列离子方程式中错误的是________。
a.少量CO2通入次氯酸钠溶液中:CO2+H2O+ClO-===HCO3—+HClO
b.少量SO2通入次氯酸钙溶液中:Ca2++2ClO-+SO2+H2O===CaSO3↓+2HClO
c.过量CO2通入澄清石灰水中:CO2+OH-=== HCO3—
查看答案和解析>>
科目:高中化学 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
“ZEBRA”蓄电池的结构如图所示,

电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。下列关于该电池的叙述错误的是
A.电池反应中有NaCl生成
B.电池的总反应是金属钠还原三个铝离子
C.正极反应为:NiCl2+2e-=Ni+2Cl-
D.钠离子通过钠离子导体在两电极间移动
查看答案和解析>>
科目:高中化学 来源:2014~2015学年黑龙江省高二上学期期中化学试卷(解析版) 题型:选择题
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是
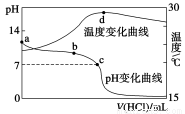
A.a点由水电离出的c(H+)=1.0×10-14 mol·L-1
B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高二9月月考B层化学试卷(解析版) 题型:选择题
某有机物4.6克,完全燃烧后的产物依次通过浓硫酸与NaOH溶液,分别增重5.4克与8.8克,该有机物可能是( )
A、CH4 B、C2H4 C、C2H6 D、C2H6O
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高二9月月考A层化学试卷(解析版) 题型:实验题
(8分)亚铁是血红蛋白重要组成成分,起着向人体组织传送O2的作用,如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害。下面是一种常见补药品说明书中的部分内容:该药品含Fe2+33%~36%,不溶于水但能溶于人体中的胃酸:与Vc(维生素C)同服可增加本品吸收。
(一)甲同学设计了以下下实验检测该补铁药品中是否含有Fe2+并探究Vc的作用:

(1)加入新制氯水后溶液中发生的离子反应方程式是________________、Fe3+ +SCN- [Fe(SCN) ]2+ 。
[Fe(SCN) ]2+ 。
(2)加入KSCN溶液后溶液变为淡红色,说明溶液中有少量Fe3+。该离子存在的原因可能是(填编号)_____________________。
A.药品中的铁本来就应该以三价铁的形式存在
B.在制药过程中生成少量三价铁
C.药品储存过程中有少量三价铁生成
(3)药品说明书中“与Vc同服可增加本品吸收”请说明理由_______________________。
(二)乙同学采用在酸性条件下用高锰酸钾标准溶液滴定的方法测定该药品是否合格,反应原理为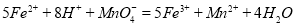 。准确称量上述药品10.00g,将其全部溶于试剂2中,配 制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
。准确称量上述药品10.00g,将其全部溶于试剂2中,配 制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
(4)该实验中的试剂2与甲同学设计的实验中的试剂1都可以是______(填序号)。
A.蒸馏水 B.稀盐酸 C.稀硫酸 D.稀硝酸
(5)本实验滴定过程中操作滴定管的图示正确的是_______(填编号)。

(6)请通过计算,说明该药品含“铁”量是否合格(写出主要计算过程)?
查看答案和解析>>
科目:高中化学 来源:2014~2015学年江西赣州赣县中学北校区高一9月月考化学试卷(解析版) 题型:选择题
下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是 ( )
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A.①和② B.①和③ C.③和④ D.①和④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com