
【题目】有A,B,C,D,E五种短周期元素,已知相邻的A,B,C,D四种元素原子核外共有56个电子,在周期表中的位置如图所示.E的单质可与酸反应,1mol E单质与足量酸作用,在标准状况下能产生33.6L H2;E的阳离子与A的阴离子核外电子层结构完全相同.
回答下列问题: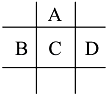
(1)A与E形成的化合物的化学式是 .
(2)B的最高价氧化物化学式为 , C的元素名称为 , D的单质与水反应的方程式为
.
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是 , 有关反应的离子方程式为 .
【答案】
(1)Al2O3
(2)P2O5;硫;Cl2+H2O=HCl+HClO
(3)先有白色胶状沉淀产生并逐渐增多,随NaOH溶液加入又逐渐溶解最终澄清;Al3++3OH﹣=Al(OH)3↓、Al(OH)3+OH﹣=AlO2﹣+2H2O
【解析】解:A、B、C、D、E五种短周期元素,由位置图可知,A在第二周期,B、C、D处于第三周期,设C的质子数为x,则A的质子数为x﹣8,B的质子数为x﹣1,D的质子数为x+1,A、B、C、D四种元素原子核外共有56个电子,则x+(x﹣8)+(x﹣1)+(x+1)=56,解得x=16,故C为S,A为O,B为P,D为Cl;1molE单质与足量酸作用,在标准状况下能产生33.6LH2 , 设E的化合价为y,根据电子转移守恒:1mol×y= ![]() ×2×1,解得y=3,E的阳离子与A的阴离子核外电子层结构完全相同,则E为Al,(1)A与E形成的化合物为氧化铝,化学式为Al2O3 , 所以答案是:Al2O3;(2)P的最高价为+5价,则最高价氧化物为P2O5 , C元素名称为硫,D的单质为氯气,氯气与水反应生成HCl与HClO,反应方程式为:Cl2+H2O=HCl+HClO,所以答案是:P2O5;硫;Cl2+H2O=HCl+HClO;(3)D和E形成的化合物为AlCl3 , 水溶液中滴入过量烧碱溶液,开始有白色胶状沉淀生成并逐渐增多,随NaOH溶液的加入又逐渐溶解,最终澄清,有关离子方程式为:Al3++3OH﹣=Al(OH)3↓、Al(OH)3+OH﹣=AlO2﹣+2H2O所以答案是:先有白色胶状沉淀产生并逐渐增多,随NaOH溶液加入又逐渐溶解最终澄清;Al3++3OH﹣=Al(OH)3↓、Al(OH)3+OH﹣=AlO2﹣+2H2O.
×2×1,解得y=3,E的阳离子与A的阴离子核外电子层结构完全相同,则E为Al,(1)A与E形成的化合物为氧化铝,化学式为Al2O3 , 所以答案是:Al2O3;(2)P的最高价为+5价,则最高价氧化物为P2O5 , C元素名称为硫,D的单质为氯气,氯气与水反应生成HCl与HClO,反应方程式为:Cl2+H2O=HCl+HClO,所以答案是:P2O5;硫;Cl2+H2O=HCl+HClO;(3)D和E形成的化合物为AlCl3 , 水溶液中滴入过量烧碱溶液,开始有白色胶状沉淀生成并逐渐增多,随NaOH溶液的加入又逐渐溶解,最终澄清,有关离子方程式为:Al3++3OH﹣=Al(OH)3↓、Al(OH)3+OH﹣=AlO2﹣+2H2O所以答案是:先有白色胶状沉淀产生并逐渐增多,随NaOH溶液加入又逐渐溶解最终澄清;Al3++3OH﹣=Al(OH)3↓、Al(OH)3+OH﹣=AlO2﹣+2H2O.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(g);△H=﹣483.6kJ/mol,则氢气的燃烧热为241.8kJ
B. 已知4P(红磷,s)=P4(白磷,s);△H>0,则白磷比红磷稳定
C. 含20.0g NaOH的稀溶液与稀硫酸完全中和,放出28.7kJ的热量,则表示该反应中和热的热化学方程式为:NaOH(aq)+ ![]() H2SO4(aq)=
H2SO4(aq)= ![]() Na2SO4(aq)+H2O(l);△H=﹣57.4kJ/mol
Na2SO4(aq)+H2O(l);△H=﹣57.4kJ/mol
D. 己知C(s)+O2(g)=CO2(g);△H1 C(s)+ ![]() O2(g)=CO(g);△H2 则△H1>△H2
O2(g)=CO(g);△H2 则△H1>△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某合金与铁的物理性质的比较如下表所示,还知该合金耐腐蚀、强度大,从以上性能看,该合金不适合做
熔点/℃ | 密度(g/cm3) | 硬度(金刚石为10) | 导电性(银为100) | |
某合金 | 2500 | 3.00 | 7.4 | 2.3 |
铁 | 1535 | 7.86 | 4.5 | 17 |
A. 导线 B. 门窗框 C. 炉具 D. 飞机外壳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH3→CH3CH2Cl→CH2=CH2→CH3CH2OH的转化过程中,经过的反应类型是( )
A.取代→加成→氧化
B.加成→取代→消去
C.取代→消去→加成
D.取代→消去→水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 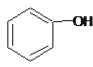 和
和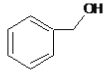 分子组成相差一个—CH2—,因此是同系物关系
分子组成相差一个—CH2—,因此是同系物关系
B. ![]() 和
和 ![]() 均是芳香烃,
均是芳香烃,![]() 既是芳香烃又是芳香族化合物
既是芳香烃又是芳香族化合物
C. 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以初步推测有机物结构简式一定为C2H5-OH
D. 分子式为C4H8的有机物可能存在4个C—C单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把下列四种X溶液分别加入四个盛有10 mL 2 mol/L盐酸的烧杯中,均加水稀释到50 mL,此时,X和盐酸缓慢地进行反应,其中反应最快的是( )
A.10 ℃,20 mL 3 mol/L 的X溶液
B.20 ℃,30 mL 2 mol/L的X溶液
C.20 ℃,10 mL 4 mol/L的X溶液
D.10 ℃,10 mL 2 mol/L的X溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3.2g铜与过量的硝酸(8mol/L,30mL)充分反应,硝酸的还原产物是NO和NO2 , 反应后溶液中含有amolH+ , 则此时溶液中含有NO3﹣的物质的量为( )
A.(0.1+a)mol
B.(0.2+a)mol
C.(0.05+a)mol
D.amol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com