

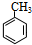
 ;
;分析 甲苯和溴乙烷中加入试剂A并加热然后分液得到油层、水层,水层中得到乙醇,溴乙烷和氢氧化钠的水溶液、加热得到乙醇,所以试剂A为NaOH的水溶液,甲苯不溶于水,则物质X为 ,水层中含有NaBr、乙醇和水,加入生石灰然后蒸馏得到乙醇,乙醇和试剂B在一定条件下发生反应生成Y,如果Y是乙烯,乙醇在浓硫酸作催化剂、加热170℃时发生消去反应生成乙烯,再结合题目解答.
,水层中含有NaBr、乙醇和水,加入生石灰然后蒸馏得到乙醇,乙醇和试剂B在一定条件下发生反应生成Y,如果Y是乙烯,乙醇在浓硫酸作催化剂、加热170℃时发生消去反应生成乙烯,再结合题目解答.
解答 解:甲苯和溴乙烷中加入试剂A并加热然后分液得到油层、水层,水层中得到乙醇,溴乙烷和氢氧化钠的水溶液、加热得到乙醇,所以试剂A为NaOH的水溶液,甲苯不溶于水,则物质X为 ,水层中含有NaBr、乙醇和水,加入生石灰然后蒸馏得到乙醇,乙醇和试剂B在一定条件下发生反应生成Y,如果Y是乙烯,乙醇在浓硫酸作催化剂、加热170℃时发生消去反应生成乙烯,
,水层中含有NaBr、乙醇和水,加入生石灰然后蒸馏得到乙醇,乙醇和试剂B在一定条件下发生反应生成Y,如果Y是乙烯,乙醇在浓硫酸作催化剂、加热170℃时发生消去反应生成乙烯,
(1)通过以上分析知,X结构简式为 ,故答案为:
,故答案为: ;
;
(2)乙醇和水互溶,所以不能采用分液方法分离,二者熔沸点不同,所以可以采用蒸馏方法分离,故答案为:否;乙醇易溶于水;
(3)甲苯和氢氧化钠溶液不反应,溴乙烷和NaOH水溶液在加热条件下发生取代反应生成乙醇,反应方程式为C2H5Br+NaOH $→_{△}^{水}$C2H5OH+NaBr,
故答案为:C2H5Br+NaOH $→_{△}^{水}$C2H5OH+NaBr;
(4)如果Y是乙烯,乙醇在浓硫酸作催化剂、加热170℃时发生消去反应生成乙烯,所以B为浓硫酸、反应条件是170℃,
故答案为:浓硫酸;170℃.
点评 本题考查有机推断、物质的分离和提纯,侧重考查学生分析、推断、基本操作等知识点,根据物质的性质采用合适的分离和提纯方法,熟练掌握常见物质的分离和提纯方法,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中消耗铝的质量相同 | |
| B. | 反应中转移的电子数相同 | |
| C. | 反应中消耗的HCl与NaOH物质的量相同 | |
| D. | 溶液增加的质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水中的溶质是NH3•H2O | |
| B. | NH3有碱性,所以能使湿润的红色石蕊试纸变蓝色 | |
| C. | 所有的铵盐都易溶于水,且受热易分解 | |
| D. | 常温下,浓硫酸、浓硝酸与铁、铝均不反应,所以可用铁制的容器来储存和运输 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com