
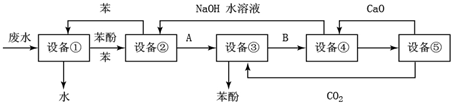
 回答下列问题:
回答下列问题:分析 由流程图和每一步新加的试剂可知:用苯萃取出设备①中的苯酚,分液后进入设备②,然后用NaOH溶液将设备②中的苯酚转化为苯酚钠而进入设备③,向设备③中通入CO2将苯酚钠转化为苯酚,同时生成NaHCO3而进入设备④,向设备④中加入CaO时,生成CaCO3进入设备⑤,NaOH进入设备②循环使用,以此来解答.
解答 解:由流程图和每一步新加的试剂可知:用苯萃取出设备①中的苯酚、分液后进入设备②,然后用NaOH溶液将设备②中的苯酚转化为苯酚钠而进入设备③,向设备③中通入CO2将苯酚钠转化为苯酚,同时生成NaHCO3而进入设备④,向设备④中加入CaO时,生成CaCO3进入设备⑤,NaOH进入设备②循环使用,
(1)由以上分析,用苯萃取出设备①中的苯酚进入设备②,所以设备①进行的是操作是分液,所有的仪器为分液漏斗和烧杯,故答案为:分液;分液漏斗和烧杯;
(2)由以上分析,用NaOH溶液将设备②中的苯酚转化为苯酚钠而进入设备③,向设备③中通入CO2将苯酚钠转化为苯酚,同时生成NaHCO3而进入设备④,所以A是C6H5ONa,B是NaHCO3,故答案为:C6H5ONa;NaHCO3;
(3)由以上分析,向设备③中通入CO2将苯酚钠转化为苯酚,方程式为C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3;
(4)根据(2)在设备④中,物质B的水溶液即NaHCO3和CaO反应CaCO3、NaOH和水,再通过过滤分离出碳酸钙,故答案为:过滤;
(5)能循环使用的物质是在流程中生成的副产物,并且在流程中需要加入的原料,根据流程图中箭头指向,很容易发现能循环使用的物质是C6H6、CaO、NaOH水溶液、CO2,故答案为:NaOH水溶液;CO2.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握有机物的结构与性质、混合物分离提纯方法、流程中的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用及实验技能的应用,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径大小:S2->Cl->F->Na+>Al3+ | |
| B. | 热稳定性大小:SiH4<PH3<NH3<H2O<HF | |
| C. | 熔点高低:金刚石>石墨>食盐>干冰>碘晶体 | |
| D. | 沸点高低:NH3>AsH3>PH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. ,用电子式表示FM2的形成过程
,用电子式表示FM2的形成过程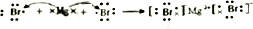 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
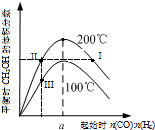 在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)达到平衡,平衡时CH3OH 的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )
在体积为2L的恒容密闭容器中加入0.6mol的CO和H2混合气体,在不同温度下反应CO(g)+2H2(g)?CH3OH(g)达到平衡,平衡时CH3OH 的体积分数随起始n(CO):n(H2)的变化关系如图所示.则下列结论正确的是( )| A. | 反应CO(g)+2H2(g)?CH3OH(g)的△H<0 | |
| B. | 图示a点n(CO):n(H2)=0.5,CO转化率最高 | |
| C. | 若在状态Ⅰ和Ⅱ时,再向体系中充入He,重新达到平衡:c(CH3OH,状态Ⅱ)=c(CH3OH,状态Ⅰ) | |
| D. | 正反应速率ν正:ν正(状态Ⅱ)>ν正(状态Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
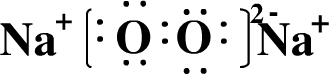 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含离子键的化合物才是离子晶体 | |
| B. | (NH4)2SO4晶体是含有离子建、共价键和配位键的分子晶体 | |
| C. | 由于I-I中的共价键键比F-F、Cl-Cl、Br-Br都弱,因此在卤素单质中I2的熔点、沸点最低 | |
| D. | 分子晶体中一定不存在离子键,而离子晶体中可能存在共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com