
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外最外层共有24个电子,在周期表中的位置如图所示.E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同
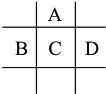
回答下列问题:
(1) A与E形成的化合物的化学式是__________.B的最高价氧化物化学式为_____________,
(2)D的单质与水反应的方程式为__________________________________________________.
(3) 向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是___________________:有关反应的离子方程式为:_____________________________________.
【答案】Al2O3 P2O5 Cl2 + H2O = HCl + HClO 先产生白色胶状沉淀,后又逐渐溶解 Al3+ + 3OH- = Al(OH)3↓、Al(OH)3 + OH- = AlO2- + 2H2O
【解析】
观察这些元素的位置关系推断A位于第二周期,BCD位于第三周期,设C的最外层电子数为x,那么A的最外层电子数为x,B的最外层电子数为x-1,D的最外层电子数为x+1,得x+x+x-1+x+1=24,x=6,因最外层电子数等于主族序数,即AC位于第ⅥA族,则A为O元素,C为S元素,继而B为P元素,D为Cl元素。设E的价态为+n,则E与盐酸的化学方程式可写为E + nHCl = ECln + ![]() H2↑,n(E):n(H2)=1:
H2↑,n(E):n(H2)=1:![]() ,其中n(E)=1mol,n(H2)=
,其中n(E)=1mol,n(H2)=![]() mol=1.5mol,带入数据于上述方程中,解得n=3,由题意知E3+与A的阴离子,即O2-,核外电子层结构完全相同可推知E是Al元素。
mol=1.5mol,带入数据于上述方程中,解得n=3,由题意知E3+与A的阴离子,即O2-,核外电子层结构完全相同可推知E是Al元素。
故ABCDE分别为O、P、S、Cl、Al。
(1)AE分别为O和Al,其构成的化合物的化学式为Al2O3,B是P元素,其最高正价为+5,因而它最高价氧化物化学式是P2O5。
(2)D的单质是Cl2,与水反应生成盐酸和次氯酸,化学方程式为Cl2 + H2O = HCl + HClO。
(3)D与E形成的化合物为AlCl3,向其水溶液中滴入烧碱溶液,Al3+和OH-反应生成Al(OH)3白色胶状沉淀,当Al3+恰好完全反应,继续滴加碱液,Al(OH)3和OH-反应生成AlO2-和水。因而现象是先产生白色胶状沉淀,后又逐渐溶解,有关离子方程式为Al3+ + 3OH- = Al(OH)3↓、Al(OH)3 + OH- = AlO2- + 2H2O。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】有机物A蒸气的密度是相同条件下氢气密度的29倍,5.8 g A在氧气中完全燃烧生成13.2 g CO2和5.4 g H2O。
(1)请通过计算确定A的分子式_______。(写出计算过程)
(2)已知A的1H核磁共振氢谱如下图所示,则A的结构简式为______________________。
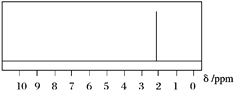
(3)已知B、C都是A的同分异构体。
①若B可发生银镜反应,则此反应的化学方程式为__________________________________。
②若C无甲基且可与金属钠反应,则C的结构简式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2A(g)+B(g)![]() 2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
2C(g) ΔH=-a kJ·mol-1(a>0),在一个有催化剂的固定容积的容器中加入2 mol A和1 mol B,在500 ℃时充分反应达平衡后,C的浓度为ω mol·L-1,放出的热量为b kJ。
(1)已知:A(g)+X(g)![]() 2B(g) ΔH=-133.2 kJ·mol-1;
2B(g) ΔH=-133.2 kJ·mol-1;
5A(g)+X(g)![]() 4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
4C(g) ΔH=-650.4 kJ·mol-1。则a=________。
(2)不同温度下该反应的平衡常数如表所示。由此可推知,表中T1________T2(填“>”“=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2 mol C,500 ℃时充分反应达平衡后,吸收热量为c kJ,C的浓度________________ω mol·L-1(填“>”“=”或“<”),a、b、c之间的关系为________________。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是________(填序号)。
A.4 mol A和2 mol B
B.4 mol A、2 mol B和2 mol C
C.4 mol A和4 mol B
D.6 mol A和4 mol B
(4)若将上述容器改为恒压容器(反应前体积相同),起始时加入2 mol A和1 mol B,500 ℃时充分反应达平衡后,放出的热量为d kJ,则d________b(填“>”“=”或“<”),理由是____________________________________。
(5)在一定温度下,向一个容积可变的容器中,通入3 mol A和2 mol B及固体催化剂,充分反应,平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4 mol A、3 mol B和2 mol C,则平衡时A的百分含量________(填“不变”“变大”“变小”或“无法确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】证明某溶液中不含Fe3+而可能含有Fe2+的实验操作如下:①加入足量新制氯水,②加入足量酸性高锰酸钾溶液,③加入少量硫氰化铵溶液,④加入氢氧化钠溶液。最佳的实验操作及顺序是( )
A.①③B.③②C.③①D.④①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列实验装置进行的相应实验,错误的是( )
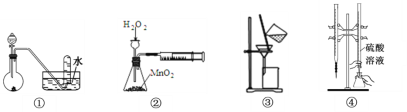
A. 用①图装置,进行H2O2分解制取少量O2的实验
B. 用②图装置,进行测定H2O2的分解速率的实验
C. 用③图装置,进行分离Fe(OH)3胶体和NaCl溶液的实验
D. 用④图装置,进行用已知浓度的硫酸溶液测定NaOH溶液浓度的实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家提出如下光分解法制备氢气:
①2Ce4+(aq)+H2O(l)===2Ce3+(aq)+![]() O2(g)+2H+(aq) ΔH1
O2(g)+2H+(aq) ΔH1
②Ce3+(aq)+H2O(l)===Ce4+(aq)+![]() H2(g)+OH-(aq) ΔH2
H2(g)+OH-(aq) ΔH2
③H2O(l)===H+(aq)+OH-(aq) ΔH3
④2H2O(l)===2H2(g)+O2(g) ΔH4
下列说法正确的是( )
A. Ce4+能够增大水分解反应的活化能,提高反应速率
B. Ce3+是反应②和反应③的催化剂
C. 上述反应中,ΔH4=2ΔH1+4ΔH2-4ΔH3
D. 通常条件下,反应④中生成H2、O2的速率之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com