
分析 (1)涉及物质有无机物和有机物,无机物有酸、碱和盐;
(2)乙醛含有醛基,乙醇有3种H;
(3)乙酸和乙醇发生酯化反应生成乙酸乙酯.
解答 解:(1)题中①②④⑦属于无机物,其中①②属于盐溶液,④属于酸溶液,⑦属于碱溶液,③⑤⑥⑧属于有机物的水溶液,
故答案为:③⑤⑥;属于有机物;
(2)乙醛含有醛基,乙醇有3种H,乙醇分子核磁共振氢谱有3个波峰,故答案为:醛基;3;
(3)乙酸和乙醇发生酯化反应生成乙酸乙酯,结构简式为CH3COOCH2CH3,故答案为:CH3COOCH2CH3;取代(酯化).
点评 本题考查较为综合,涉及物质的分类以及有机物的性质,为高频考点,侧重考查学生的分析能力,注意把握有机物的官能团的性质,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②④⑦ | B. | ①②③④ | C. | ①②③⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H8O2 | B. | C5H10O2 | C. | C6H12O2 | D. | C7H14O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 800 | 54.0 | a | b |
| 900 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 4个 | B. | 3个 | C. | 2个 | D. | 1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
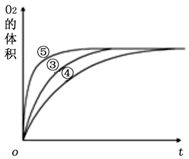 实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
实验小组用0.50mol/L KOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 项目 数据 次数 | 起始温度T1/℃ | 终止温度T2/℃ | 温度差平均值 (T2-T1)/℃ | ||
| H2SO4 | KOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 3 | 26.4 | 26.2 | 26.3 | 30.4 | |
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | 10 mL 5% H2O2溶液 | 无 |
| ③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol•L-1 X溶液 |
| ④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol•L-1 X溶液 |
| ⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol•L-1 X溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 g | B. | 10 g | C. | 20 g | D. | 30 g |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com