
| A. | 常温常压下,3.0g含甲醛的冰醋酸中含有的原子总数为0.4 NA | |
| B. | 标准状况下,2.24L苯中含有的C-H键的数目为0.6NA | |
| C. | 1 L 0.01 mol•L-1 KAl(SO4)2溶液中,含有的阳离子数目为0.02NA | |
| D. | 反应KIO3+6HI=3I2+KI+3H2O,每生成1.5mol I2转移电子数为3NA |
分析 A、甲醛和冰醋酸的最简式为CH2O,3.0g混合物中含有0.1mol最简式;
B、标况下,苯为液态;
C、根据n=cV计算出溶质硫酸铝钾的物质的量,铝离子部分水解,导致阳离子数目增多;
D、I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,转移5e-.
解答 解:A、3.0g含甲醛的冰醋酸中含有0.1mol最简式CH2O,含有0.4mol原子,含有的原子总数为0.4NA,故A正确;
B、标况下,苯为液态,故不能根据气体摩尔体积来计算,故B错误;
C、1L 0.01mol•L-1 KAl(SO4)2溶液中含有0.01mol硫酸铝钾,由于铝离子部分水解,则溶液中含有的阳离子的物质的量大于0.02mol,含有的阳离子数目大于0.02 NA,故C错误;
D、在反应KIO3+6HI=KI+3I2+3H2O中,I元素的化合价由+5价降低为0,I元素的化合价由-1价升高为0,生成3mo1I2转移的电子数为5NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:解答题
| A | A的一种单质在自然界中硬度最大 |
| B | B元素的第一电离能比同周期相邻两个元素都大 |
| C | 同周期中,C元素的最高价氧化物对应的水化物的碱性最强 |
| D | D的基态原子M层电子数是K层的2 倍 |
| E | E与C位于不同周期,E原子核外最外层电子数与C相同,其余各层电子均充满 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
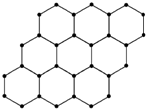
| A. | 石墨烯与石墨互称为同位素 | |
| B. | 12 g石墨烯中约含有6.02×1023个电子 | |
| C. | 石墨烯中可能含有离子键 | |
| D. | 石墨烯中的碳原子间以共价键相结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题:
有X、Y、Z、W、P、Q六种前两周期的主族元素,原子序数依次增大,价电子数之和为26,原子半径依Y、Z、W、P、Q、X依次减小.围绕上述元素,回答下列问题: ,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”).
,YQ3中心原子的杂化类型为sp2,Z与Q两元素第一电离能的大小关系:Z<Q(填“>”、“<”或“=”). ,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其与水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3的溶解性比NaHCO3小 | |
| B. | SiO2与酸、碱均能反应,属于两性氧化物 | |
| C. | NO2溶于水时发生氧化还原反应 | |
| D. | Fe在足量Cl2中燃烧生成FeCl2和FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
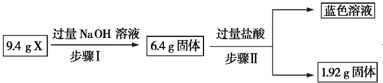
| A. | 根据上述步骤Ⅱ可以得出蓝色溶液中n(Cu2+)=0.02 mol | |
| B. | 步骤Ⅱ中质量减少的固体物质一定是Fe2O3 | |
| C. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| D. | 根据步骤Ⅰ、Ⅱ可以判断X中氧化铁的质量分数为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 仪器 |
| A | 用溴水和CCl4除去NaBr溶液中少量NaI | 烧杯、玻璃棒、胶头滴管、分液漏斗 |
| B | 配制100mL l.0mol•L-1的NaOH溶液 | 药匙、天平、量筒、烧杯、玻璃棒、胶头滴管、100mL的容量瓶 |
| C | 从食盐水中获得NaCl晶体 | 酒精灯、玻璃棒、坩埚、泥三角 |
| D | 用盐酸除去BaSO4中混有的少量BaCO3 | 漏斗,烧杯、玻璃棒、胶头滴管、滤纸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
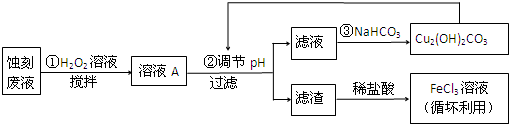
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com