
����Ŀ��������(��ɫ��״���壬�۵�122.4��)�ɹ㷺����ҽҩ��Ⱦ�����塢���ϵȣ�ʵ�����üױ���������Ʊ������ᡣ��Ӧ����ʽ���£�
![]() +2KMnO4
+2KMnO4![]()
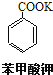 +KOH+2MnO2��+H2O
+KOH+2MnO2��+H2O
![]() +HCl��
+HCl��![]() +KCl
+KCl
��֪�йػ������������������ʾ��
������ | ��Է������� | �ܶ�(g/cm3) | �ܽ��� | �е�(��) |
�ױ� | 92 | 0.87 | ������ˮ | 110.0 |
������� | 160 | �� | ������ˮ | �� |
������ | 122 | 1.26 | ����ˮ | 248.0 |
��������100gˮ�е��ܽ��0.18g(4��)��0.27g(18��)��2.2g(75��)��
�ϳɣ�����ͼ(�̶�������װ����ȥ)��ʾ����������ƿ�м���4.23mL�ױ���100mL����ˮ��ƿ��װ���¶ȼơ��綯�������������ܣ����������綯�����������������ڡ����������Ͽڷ�������21.30g�������(����)������������ױ�����ʧ������Һ�в��ٳ�������Ϊֹ���õ���Ӧ����
�Է�Ӧ�������з��룺�����ȹ�������ϴ�����������ϲ���Һ��ϴ��Һ������ȴ���������ữ�������ˡ�
�Դֲ�Ʒ����������ᴿ������ˮ�ܽ���������̿��ɫ�������ȹ�������_________������������ϴ���������
��ش��������⣺
��1��ʵ��������ȡ4.23mL�ױ���������Ϊ_________��
��2�������ܵ��Ͽ��Ƿ���Ҫ��������________(����������������)��a��ˮ��������_______(������ˮ��������ˮ��)��
��3�����������Ҫ�������룬���û�ѧ��Ӧ���ʹ۵�˵������_________��
��4���ڶԴֲ�Ʒ����������ᴿ�����У��������ȹ�������Ŀ����_________�����ܡ��IJ���������________����֤������ϴ����������ϴ�Ӹɾ��ķ�����_____________��
��5�����������ñ�����2.93g������IJ���Ϊ________��
���𰸡���1����ʽ�ζ��ܣ�
��2����ˮ
��3�����ⷴӦ���죬ʹ��ӦҺ�ӻ������϶������
��4����ȥ����̿�����ٱ�����ᾧ���� ��ȡ���һ��ϴ��Һ��������HNO3�ữ��AgNO3��Һ�����ް�ɫ�̶����ɣ�˵��������ϴ�Ӹɾ���(��ȡ���һ��ϴ��Һ�ѳ���ɫҲ��) ��
��5��60.0%
��������
�����������1���������ڼױ����������ü�ʽ�ζ�����ȡ����ʵ����ȷ��ȡ4.23mL�ױ���������Ϊ��ʽ�ζ��ܣ��ʴ�Ϊ����ʽ�ζ��ܣ�
��2�������ܵ��Ͽڲ���Ҫ�������ӣ�a��ˮ�������ǽ�ˮ���ʴ�Ϊ����ˮ��
��3�����������Ҫ�������룬�û�ѧ��Ӧ���ʹ۵�˵������Ϊ���ⷴӦ���죬ʹ��ӦҺ�ӻ������϶��磬�ʴ�Ϊ�����ⷴӦ���죬ʹ��ӦҺ�ӻ������϶��磻
��4���ɱ������ݿ�֪���¶ȸ߱�������ܽ�ȴ��ڶԴֲ�Ʒ����������ᴿ�����У��������ȹ�������Ŀ���dz�ȥ����̿�����ٱ�����ᾧ���������ܡ��IJ��������� ��ȴ�ᾧ����֤������ϴ����������ϴ�Ӹɾ��ķ�����ȡ���һ��ϴ��Һ��������HNO3�ữ��AgNO3��Һ�����ް�ɫ�������ɣ�˵��������ϴ�Ӹɾ����ʴ�Ϊ����ȥ����̿�����ٱ�����ᾧ��������ȴ�ᾧ��ȡ���һ��ϴ��Һ��������HNO3�ữ��AgNO3��Һ�����ް�ɫ�������ɣ�˵��������ϴ�Ӹɾ���
��5������4.23mL�ױ��������ϵõ�������Ϊ![]() mol��122g/mol=4.88g������IJ���Ϊ
mol��122g/mol=4.88g������IJ���Ϊ![]() ��100%=60%���ʴ�Ϊ��60%��
��100%=60%���ʴ�Ϊ��60%��


 ���Ǽ���С����ϵ�д�
���Ǽ���С����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M��R��X��YΪԭ��������������Ķ���������Ԫ�أ�Z��һ�ֹ���Ԫ�ء�M��̬ԭ��L����p �����������s�����������2����R��ͬ����Ԫ��������õĽ���Ԫ�أ�X��M�γɵ�һ�ֻ������������������Ҫ������Ⱦ�Z�Ļ�̬ԭ��4s��3d����������
�ݴ���ش��������⣺
��1��R��̬ԭ�ӵĵ����Ų�ʽ�� ��X��Y�е縺�Խϴ���� ����Ԫ�ط��ţ���
��2��X���⻯��ķе��������������Ƶ�M���⻯���ԭ���� ��
��3��X��M�γɵ�XM3���ӵĿռ乹���� ��
��4��M��R���γɵ�һ�����ӻ�����R2M����ľ�������ͼ��ʾ����ͼ�к�������������� �������ӷ��ţ���

��5����ϡ�����У�Z����ۺ�����ļ��Σ���ɫ������M��һ���⻯�Z����ԭΪ+3�ۣ��÷�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���A��B��C��D��E�ܷ�����ͼ��ʾ��ת��������������й����⣺
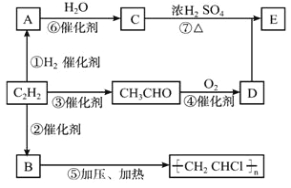
��1��C�й����ŵ����� ��
��2����Ӧ���Ļ�ѧ����ʽ ����Ӧ����Ϊ ��
��3��ij��X�����ʽ������C2H2����ͬ��X��������������ܶ�Ϊ39����ȡ��֧�Թܣ��ֱ����������ˮ��ʵ��������������£�
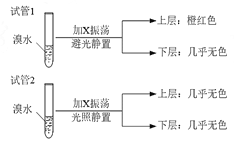
�й�X��˵����ȷ����
A��X������ˮ
B��ú̿�к���������
C��Xʹ��ˮ��ɫ����Ϊ�����ӳɷ�Ӧ
D��������Թ�2�е��л������ϲ㻹���²㣬��ͨ����ˮȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(Na3N)�ǿ�ѧ���Ʊ���һ����Ҫ���������ˮ���ÿ�����NH3 ��һ��ǿ��ش��������⣺
��1�������Ƶĵ���ʽ�� ���û������� ������(ѡ����ӡ��������ۡ�)��
��2����������ˮ��Ӧ�Ļ�ѧ����ʽ�� ���÷�Ӧ���� ��Ӧ��
��3�������������ᷴӦ���� ���Σ����� (���εĻ�ѧʽ)�Ⱥ����Ӽ��ֺ��й��ۼ���
��4�����������������İ뾶��С�Ƚϣ� r(Na+) r(N3��)(����ڡ�����С�ڡ����ڡ�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���й���Ȼ����ˮ�����������ȷ����
A����֬ˮ��ɵõ�������
B����ѿ��ˮ��ֻ����������
C��������ˮ������ղ����Ϊ������
D����ά��ˮ�������ˮ��õ������ղ��ﲻͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��G��I��Ϊǰ������ԭ���������������Ԫ�ء�Aԭ�ӵ�L���Ӳ��p�ܼ�����һ���չ����C���������6���˶�״̬��ͬ���ӣ�D�Ļ�̬ԭ����Χ�����Ų�ʽΪ3S2��E��Dͬ���ڣ����ڸ������е縺�����F��G��ͬ����ԭ��������2��Ԫ�أ�I�Ļ�̬ԭ����Χֻ��һ�������ӡ�
��1�� ���й���A2H4���Ӻ�H2C2���ӵ�˵����ȷ���� ��
A���������������������
B������ԭ�Ӷ�sp2�ӻ�
C�����Ǻ����Լ��ͷǼ��Լ��ķǼ��Է���
D����Ϊ�ȵ�����
E��A2H4���ӵķе����Ե���H2C2����
��2��A��B��C����Ԫ���е����֣����γ�ԭ�Ӹ�����Ϊl��3�ij��������Ʋ����������Ŀռ乹��Ϊ ��
��3��E���γɶ��ֺ����ᣬ��HEO3��HEO2�����������HEO3����HEO2��ԭ�� ��
��4�� G��AC���γɻӷ���Һ��G(AC)4������������� ���塣
��5�� F��������ṹΪ���������ѻ���ԭ�Ӱ뾶Ϊa nm��I��������ṹΪ���������ѻ���ԭ�Ӱ뾶Ϊb nm�������ֽ������ܶȱ�Ϊ (�ú�a��b����ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȡ16.0mL 10.0molL��1HCl��Һ��������ˮϡ����100mL��ȡ����ϡ�ͺ��HCl��Һ��25mL���ֱ�����������Mg��Al����ͬ�����³�ַ�Ӧ�����������������ʱ��仯��������ͼ��ʾ���������������ɱ�״���µ������������㣺

��1��ϡ�ͺ�HCl��Һ�����ʵ���Ũ��Ϊ mol��L-1��
��2������Al������������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�������Һ��pH����7���� �� ��
A. NH4Cl B. H3PO4 C. NaHCO3 D. Na2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڵ��ص������У�����ȷ���� �� ��
A�����Դ������ӵ��ǵ��ص�����
B�����Դ������ӵ��ǵ��ص�����
C�����ص���������������Ӧ
D�����Ӵӵ�Դ�ĸ����ص���������ص�����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com