
| A. | 石墨 | B. | 水晶 | C. | 不锈钢 | D. | 陶瓷 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 苯酚沾在手上立即用酒精清洗 | B. | 误食铜盐立即喝牛奶或蛋清 | ||
| C. | 动物标本可用福尔马林浸泡防腐 | D. | 伤口处理应先用100%的乙醇消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
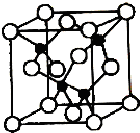 X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:
X、Y、Z、U、W是原子序数依次增大的前四周期元素.其中Y的原子核外有7种运动状态不同的电子;X、Z中未成对电子数均为2; U是第三周期元素形成的简单离子中半径最小的元素;W的内层电子全充满,最外层只有1个电子.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
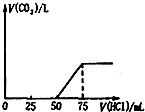 取一定物质的量浓度的NaOH 溶液1 00mL,然后向其通入一定量的CO2气体,得到溶液A,向A 中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,下列有关说法不正确的是( )
取一定物质的量浓度的NaOH 溶液1 00mL,然后向其通入一定量的CO2气体,得到溶液A,向A 中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,下列有关说法不正确的是( )| A. | A溶液中溶质Na2CO3和NaHCO3物质的量比为l:l | |
| B. | A溶液中溶质NaOH和Na2CO3物质的量比为l:l | |
| C. | 原Na0H 溶液物质的量浓度为0.075mol/L | |
| D. | 通入CO2气体在标况下的体积为56mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.9 g BaO2固体中阴、阳离子总数为0.2NA | |
| B. | 标况下,5.6 L NO和5.6 L O2的混合气体中含有的分子数为0.375NA | |
| C. | 标准状况下,11.2 L乙烯含有的极性共价键数目为NA | |
| D. | 100 mL 0.1 mol•L-1的硫酸铝溶液中含有的Al3+为0.02NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
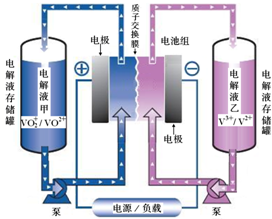 (1)全钒液流电池储能技术及应用荣获2015年国家技术发明二等奖.其结构及工作原理如图所示,电解液均呈酸性.
(1)全钒液流电池储能技术及应用荣获2015年国家技术发明二等奖.其结构及工作原理如图所示,电解液均呈酸性.| 化学式 | 电离常数 |
| HCN | K=6.2×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7 K2=4.7×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com