
| A. | 36 | B. | 24 | C. | 20 | D. | 10 |
分析 当反应达到平衡时,c(H2)=1mol/,c(HI)=4mol/L,则
②2HI(g)?H2(g)+I2(g)
2mol/L 1mol/L
①NH4I(s)?NH3(g)+HI(g)
6mol/L 4mol/L
K为生成物浓度幂之积与反应物浓度幂之积的比,固体不能代入K中,以此来解答.
解答 解:当反应达到平衡时,c(H2)=1mol/,c(HI)=4mol/L,则
②2HI(g)?H2(g)+I2(g)
2mol/L 1mol/L
①NH4I(s)?NH3(g)+HI(g)
6mol/L 4mol/L
则反应①的化学平衡常数K=6mol/L×4mol/L=24(mol/L)2,
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握反应中平衡浓度与K的关系为解答的关键,侧重分析与计算能力的考查,注意平衡时氨气的浓度,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
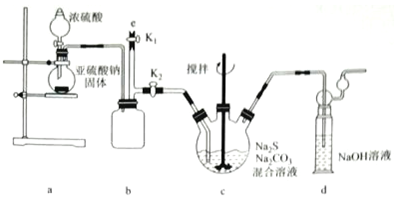
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图①表示可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0 | |
| B. | 图②表示用惰性电极电解足量氯化钠溶液.一段时间后,两极上可收集到相等体积的气体 | |
| C. | 图③表示可逆反应:A2(g)+3B2(g)?2AB3(g)△H<0 | |
| D. | 图④表示压强对可逆反应2A(g)+B(g)?3C(g)+D(s)的影响,乙压强大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素C位于周期表中第三周期ⅢA族 | |
| B. | 电解熔融化合物CE3可制取单质C | |
| C. | D的最高价含氧酸的浓溶液与单质A共热时能生成三种氧化物 | |
| D. | 化合物B2D2中既含离子键又含非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验操作及现象 |
| A | 检验1-溴丙烷中含有溴 | 将1-溴丙烷与足量氢氧化钠溶液混合加热,冷却后加硝酸银溶液,得沉淀 |
| B | 验证样品中一定含有苯酚 | 向样品溶液中滴加氯化铁溶液后显紫色 |
| C | 验证蔗糖没有水解 | 在蔗糖溶液中加入稀硫酸,水浴加热一段时间后,加入少量新制Cu(OH)2悬浊液,加热后未出现砖红色沉淀 |
| D | 证明蛋白质的变性是不可逆的 | 向蛋白质溶液中滴加CuSO4溶液,有固体析出,过滤,向固体中加足量水,固体不溶解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4酸性溶液中加入H2O2:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| B. | NaOH溶液吸收工业制硝酸的尾气:NO+NO2+2OH-═2NO3-+H2O | |
| C. | NH4HCO3溶液中滴加足量NaOH溶液:NH4++OH-═NH3•H2O | |
| D. | KIO3溶液氧化KI的酸性溶液:IO3-+5I-+3H2O═3I2↓+6OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com