
【题目】已知HA是一元弱酸
(1)常温下,下列事实能证明HA是弱电解质的是________。
①某NaA溶液的pH=9
②用HA溶液做导电实验,灯泡很暗
③等浓度、等体积的硫酸和HA溶液分别与足量锌反应,硫酸产生的氢气多
④0.1 mol·L-1 HA溶液的pH≈2.8
⑤配制相同浓度的硫酸和HA,分别测定两溶液的pH,硫酸的pH小于HA的pH
(2)某温度时,0.1 mol·L-1的HA溶液中的c(H+)与0.01 mol·L-1的HA溶液中的c(H+)的比值________(填“大于”“小于”或“等于”)10。
(3)已知:25 ℃时,HA的电离平衡常数为6.25×10-7。
①求该温度时,0.1 mol·L-1的HA溶液中c1(H+)=__________mol·L-1。[水电离出的c(H+)、c(OH-)忽略不计,下同]
②若该温度时向该溶液中加入一定量的NH4A(假设溶液体积不变),使溶液中c(A-)变为5×10-2 mol·L-1,则此时c2(H+)=________mol·L-1。
(4)已知:常温下,NH3·H2O的电离平衡常数为1.74×10-5;则 NH4A溶液呈________性,NH4A溶液中物质的量浓度最大的离子是________(填化学式)。
(5)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明):
①实验时的温度;②______________;③用_______(填一种实验方法)测定CH3COOH溶液浓度c′。
【答案】 ①④ 小于 2.5×10-4 1.25×10-6 碱 NH4+ 溶液的pH 酸碱中和滴定
【解析】(1)已知HA是一元弱酸。常温下,下列事实:①某NaA溶液的pH=9,说明A-可以水解生成弱酸HA;②用HA溶液做导电实验,灯泡很暗,没有与相同浓度的一元强酸作对比,无法说明HA是弱酸;③等浓度、等体积的硫酸和HA溶液分别与足量锌反应,因为硫酸是二元酸,所以硫酸产生的氢气多,无法证明HA是弱酸;④0.1 mol·L-1 HA溶液的pH≈2.8>1,可以证明HA是弱酸;⑤因为硫酸是二元酸,所以当硫酸和HA的浓度相同时,尽管硫酸的pH小于HA的pH,也无法证明HA是弱酸。综上所述,能证明HA是弱电解质的是①④。
(2)某温度时,把0.1 mol·L-1的HA溶液加水稀释到0.01 mol·L-1,HA的电离平衡正向移动,所以0.1 mol·L-1的HA溶液中的c(H+)与0.01 mol·L-1的HA溶液中的c(H+)的比值小于10。
(3)①求该温度时,0.1 mol·L-1的HA溶液中c1(H+)=![]() mol·L-1。②若该温度时向该溶液中加入一定量的NH4A(假设溶液体积不变),使溶液中c(A-)变为5×10-2 mol·L-1,则此时c2(H+)=
mol·L-1。②若该温度时向该溶液中加入一定量的NH4A(假设溶液体积不变),使溶液中c(A-)变为5×10-2 mol·L-1,则此时c2(H+)=![]() 1.25×10-6 mol·L-1。
1.25×10-6 mol·L-1。
(4)已知:常温下,NH3·H2O的电离平衡常数为1.74×10-5,HA的电离平衡常数为6.25×10-7,两弱电解质相比,HA是更弱的电解质,则 NH4A溶液呈碱性,NH4A溶液中物质的量浓度最大的离子是NH4+。
(5)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,根据其表达式,可以确定需测定的数据有:①实验时的温度;②溶液的pH;③用酸碱中和滴定测定CH3COOH溶液浓度c′。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
Ⅰ.(1)铁元素在周期表中的位置为___________。
(2)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是___________ (填字母)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
Ⅱ.下图是用硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、SiO2)为原料制备高纯氧化铁的生产流程示意图:

回答下列问题:
(1)酸浸、过滤后滤液A中的金属阳离子是 ___________ 。
(2)煅烧FeCO3生成产品Ⅰ的化学方程式为___________。
(3)已知几种盐的溶解度随温度变化的曲线如图所示,产品Ⅱ的化学式为 ___________ 。

(4)写出步骤Ⅳ反应的离子方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献,他以饱和食盐水、NH3、CO2为原料先制得NaHCO3,进而生产出纯碱。回答下列问题:
某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计方案实验。一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出)。

(1)装置甲中用稀盐酸与CaCO3反应制备CO2,发现CaCO3与试管内的稀盐酸不能接触,在加稀盐酸时,发现试剂瓶中的稀盐酸已用完,为使反应能顺利进行,可向长颈漏斗中加入的试剂是______________。
A.H2SO4溶液 B.CCl4 C.苯 D.稀硝酸
(2)乙装置中的试剂是______________;丁装置中稀硫酸的作用是______________。
(3)另一位同学用图中戊装置(其他装置未画出)进行实验。实验时,须先从______________管通入 __________气体。
(4)有同学建议在戊装置的b管下端连接己装置,理由是______________ 。
(5)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水):
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ | 50 ℃ | |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 |
参照表中数据,请分析丙、戊装置中使用冷却水或者冰水的原因:______________。
(6)根据侯氏制碱原理制备少量NaHCO

(7)该小组同学为了测定丙中所得晶体的碳酸氢钠的纯度(假设晶体中不含碳酸盐杂质),将晶体充分干燥后,称量质量为w g。再将晶体加热到质量不再变化时,称量所得粉末质量为m g。然后进行下图所示实验:

①在操作Ⅱ中,为了判断加入氯化钙溶液是否过量,其中正确的是 ______________ (填字母)。
a.在加入氯化钙溶液后,振荡、静置,向溶液中继续加入少量氯化钙溶液
b.在加入氯化钙溶液后,振荡、静置,向溶液中再加入少量碳酸钠溶液
c.在加入氯化钙溶液后,振荡、静置,取上层清液再加入少量碳酸钠溶液
②所得晶体中碳酸氢钠的纯度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是Al2O3、SiO2和Fe2O3等。从铝土矿中提炼Al2O3的流程如下:
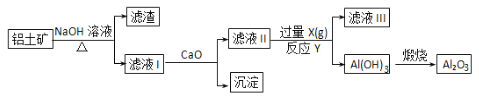
下列说法中错误的是 ( )
A. 滤液Ⅰ的主要成分是Na2SiO3、NaAlO2和NaOH
B. 滤液Ⅲ的含大量的阴离子是HCO3-
C. 反应Y的离子方程式是2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-
D. 滤液Ⅱ中通入过量的X的目的是使AlO2-充分沉淀而不引进杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,书写正确的是
A.KNO3=K++NO3ˉB.NaHSO4=Na+ +HSO4ˉ
C.Na2SO4=Na2+ +SO42ˉD.KClO3=K++Cl-+3O2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸具有的重要性质有酸性、吸水性,脱水性、强氧化性。请把下列现象中浓硫酸表現出来的性质填写在对应的空白处:
(1)把浓硫酸滴在白纸上,白纸变黑,则浓硫酸表现________;
(2)盛有浓硫酸的烧杯敞口放置一段时间,质最增加,则浓硫酸表现出________;
(3)浓硫酸与碳共热时发生反应2H2SO4(浓)+C![]() CO2↑+ 2SO2↑+2H2O,在该反应中,浓硫酸表现出________。
CO2↑+ 2SO2↑+2H2O,在该反应中,浓硫酸表现出________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com