
能正确表示下列反应的离子方程式的是
A.Cl2通入NaOH溶液:Cl2+OH-===Cl-+ClO-+H2O
B.稀盐酸溶液中加入CaCO3:CO32-+2H+===CO2↑+H2O
C.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
D.Cu溶于稀HNO3:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015-2016学年云南省高一上学期10月月考化学试卷(解析版) 题型:计算题
计算:常温下,将20.0 g 14%的NaCl溶液跟30.0 g 24%的NaCl溶液混合,得到密度为1.17 g·cm-3的混合溶液。计算:
(1)求该混合溶液中NaCl的质量分数。
(2)求该混合溶液中NaCl的物质的量浓度。
(3)求在1 000 g水中需加几摩尔氯化钠,才能使其浓度恰好与上述混合溶液浓度相等。(保留1位小数)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省杭州地区七校高一上学期期中联考化学试卷(解析版) 题型:选择题
下列关于科学家及其提出学说与贡献的叙述不对应的是
A.道尔顿提出原子学说
B.舍勒发现了氯气
C.汤姆生发现电子,并提出原子结构轨道模型
D.卢瑟福根据α粒子散射现象,提出了带核的原子结构模型
查看答案和解析>>
科目:高中化学 来源:2016届广东省高三上学期12月月考理综化学试卷(解析版) 题型:选择题
用试纸检验气体性质是一种重要的实验方法。如图所示的实验中(可加热),下列试纸的选用、现象及对应结论都正确的一项是

选项 | 试剂B | 湿润的试纸A | 现象 | 结论 |
A | 碘水 | 淀粉试纸 | 变蓝 | 碘具有氧化性 |
B | 浓氨水,生石灰 | 蓝色石蕊试纸 | 变红 | 氨气为碱性气体 |
C | Na2SO3,硫酸 | 品红试纸 | 褪色 | SO2具有漂白性 |
D | Cu,浓硝酸 | 淀粉KI试纸 | 变蓝 | NO2为酸性气体 |
查看答案和解析>>
科目:高中化学 来源:2016届广东省、潮州金中高三上学期期中联考理综化学试卷(解析版) 题型:填空题
石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下:
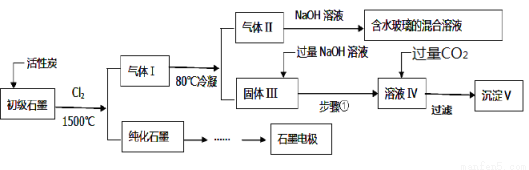
(注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃)
(1)向反应器中通入Cl2前,需通一段时间N2,主要目的是_________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物,写出由气体II中某物质得到水玻璃的化学反应方程式为_________________。
(3)步骤①为:搅拌、过滤,所得溶液IV中的三种阴离子是____________。
(4)由溶液IV生成沉淀V的反应的离子方程式为_____________,100kg初级石墨最多可获得V的质量为___________kg。
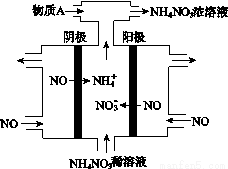
(5)使用上面提纯得到的石墨电极电解NO可制得 NH4NO3酸性溶液,其工作原理如下图所示,① 试写出电解池阴极的电极反应式 。② 为使电解产物全部转化为NH4NO3,需补充物质A,A是 ,说明理由: 。
查看答案和解析>>
科目:高中化学 来源:2016届江西省新余、 万载、宜春三校高三上学期10月联考化学试卷(解析版) 题型:推断题
已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末。其转化关系如图。

请回答:
(1)工业上制C用A不用H的原因 。
(2)写出C与K反应的化学方程式 ,该反应的反应物总能量 (填“大于”或“小于”)生成物总能量。
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 。
(4)写出E物质的电子式 。
(5)J与H反应的离子方程式为 。
(6)写出G与熟石灰反应制取漂白粉的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2016届江西省新余、 万载、宜春三校高三上学期10月联考化学试卷(解析版) 题型:选择题
一定温度下,向饱和NaOH溶液中加入一定量的钠块,充分反应后恢复到原温度,下列说法正确的是
A.溶液中溶质质量增加,溶剂质量减少,溶液中溶质的质量分数变大
B.溶液的pH不变,有氢气放出
C.溶液中的Na+数目减小,有氧气放出
D.溶液中的c(Na+)增大,有氧气放出
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江铁人中学高一上第一阶段测化学卷(解析版) 题型:选择题
相对分子质量为M的气态化合物V L(标准状况),溶于mg水中,得到质量分数为w%的溶液,物质的量浓度为cmol/L,密度为ρ g·cm-3,则下列说法正确的是
A.相对分子质量M=
B.物质的量浓度c=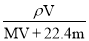
C.溶液的质量分数w%=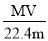
D.溶液密度ρ=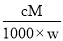
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江嘉兴一中高一上10月阶段测化学卷 (解析版) 题型:计算题
取质量为14.8 g的Na2CO3和NaHCO3的固体混合物,与100 mL 2.50 mol·L-1的盐酸恰好完全反应至不再放出气体。(提示:混合物中加入盐酸发生反应:Na2CO3+HCl===NaHCO3+NaCl,当消耗完碳酸钠时发生反应:NaHCO3+HCl===NaCl+H2O+CO2↑)
(1)求原混合物中Na2CO3的质量分数。
(2)若100 mL 2.50 mol·L-1的盐酸是用标签如图所示的浓盐酸制得,则需该浓盐酸的体积是多少?

(3)若取等质量的原混合物配成溶液,逐滴滴入90 mL2.50 mol·L-1的盐酸,并不断搅拌,求生成的气体在标准状况下的体积。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com