
| 化学式 | CaSO4 | CaCO3 | Ca(OH)2 | CaCl2 |
| 溶解度/g | 0.21 微溶 | <0.01 | 0.077 | 74.5 |
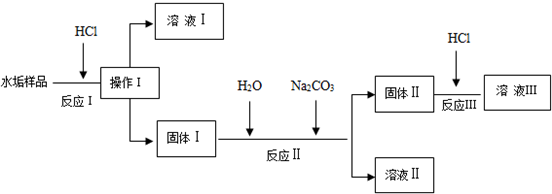
分析 由物质的溶解度及设计实验可知,加盐酸,CaCO3、Mg(OH)2均溶于盐酸,则操作I为过滤得到固体I为CaSO4,溶液I中含CaCl2、MgCl2,固体I中加碳酸钠,发生沉淀的转化生成碳酸钙和硫酸钠,则溶液II为硫酸钠,固体II为碳酸钙,再加盐酸得到溶液Ⅲ中含CaCl2,以此来解答.
解答 解:由物质的溶解度及设计实验可知,加盐酸,CaCO3、Mg(OH)2均溶于足量盐酸,则操作I为过滤得到固体I为CaSO4,溶液I中含HCl、CaCl2、MgCl2,固体I中加碳酸钠,发生沉淀的转化生成碳酸钙和硫酸钠,则溶液II为硫酸钠,固体II为碳酸钙,再加足量盐酸得到溶液Ⅲ中含HCl、CaCl2,
(1)由上述分析可知,操作Ⅰ的名称是过滤,故答案为:过滤;
(2)溶液Ⅰ和溶液Ⅲ都含有的溶质是HCl、CaCl2,故答案为:HCl、CaCl2;
(3)上述过程中符合“盐+酸=另一种盐+另一种酸”特征的反应方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O,反应Ⅱ的离子方程式为CaSO4+CO32-=CaCO3+SO42-,
故答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O;CaSO4+CO32-=CaCO3+SO42-;
(4)由上述分析可知,反应II发生沉淀的转化,利用上述溶解性表格中的数据,故答案为:B;
(5)溶液II为硫酸钠,检验硫酸根离子的方法为取少量溶液II,先加盐酸无现象,再加氯化钡生成白色沉淀,则证明含硫酸根离子,
故答案为:取少量溶液II,先加盐酸无现象,再加氯化钡生成白色沉淀,则证明含硫酸根离子.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握物质的性质、实验流程及发生的反应为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:多选题
| A. | 随核电荷数增加卤素原子半径增大 | B. | 随核电荷数增加,单质熔沸点升高 | ||
| C. | 随核电荷数增加,单质氧化性增强 | D. | 随核电荷数增加氢化物越来越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁粉只直接与溴水中的溴反应 | |
| B. | 镁粉在水的催化下与溴发生反应 | |
| C. | 产生极少量的气泡是由于镁粉与水反应得到 | |
| D. | 镁粉只与溴水中的酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与硫酸的反应 OH-+H+═H2O | |
| B. | 澄清的石灰水与稀盐酸反应 Ca(OH)2+2H+═Ca2++2H2O | |
| C. | 铜片插入硝酸银溶液中 Cu+Ag+═Cu2++Ag | |
| D. | 碳酸钙溶于稀盐酸中 CaCO3+2H+═Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 混合物成分 | 化学试剂 | 离子方程式 |
| Na2SO4中含有少量Na2CO3杂质 | ||
| FeCl2中含有少量FeCl3杂质 | ||
| NaNO3中含有少量NaCl杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨基甲酸铵是一种用途广泛的化工原料.有关它的资料如下:
氨基甲酸铵是一种用途广泛的化工原料.有关它的资料如下: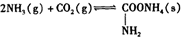
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com