
| A、酸与碱的物质的量一定相等 |
| B、溶液呈现中性 |
| C、酸与碱的物质的量浓度相等 |
| D、酸所能提供的H+与碱所能提供的OH-的物质的量相等 |


科目:高中化学 来源: 题型:
| A、含有金属元素的离子一定是阳离子,金属阳离子被还原一定得到金属单质 |
| B、pH相等的NaOH、NaHCO3和Na2CO3三种溶液:c(NaOH)<c(NaHCO3)<c(Na2CO3) |
| C、常温下,c(NH4+)相等的4种溶液:①(NH4)2SO4 ②(NH4)2Fe(SO4)2 ③NH4Cl ④(NH4)2CO3,溶质物质的量浓度大小关系是:②<①<④<③ |
| D、某温度时水的离子积常数KW=10-13若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则a:b=2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、1:2 | B、2:1 |
| C、3:1 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加压 | B、减压 |
| C、降温 | D、充入氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-542.7kJ/mol |
| B、2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1059.3kJ/mol |
| C、2N2H4(g)+N2O4(g)═3N2(g)+4H2O(g)△H=-1076.7kJ/mol |
| D、N2H4(g)+N2O4(g)═N2(g)+2H2O(g)△H=-1076.7kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
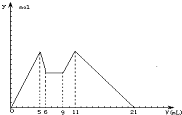 如图是向MgCl2和AlCl3混合液中,先加入NaOH溶液后又滴加盐酸,所得沉淀y(mol)与试剂体积V(mL)之间的关系.以下结论错误的是( )
如图是向MgCl2和AlCl3混合液中,先加入NaOH溶液后又滴加盐酸,所得沉淀y(mol)与试剂体积V(mL)之间的关系.以下结论错误的是( )| A、c(NaOH):c(HCl)=2:1 |
| B、原混合液中c(Al3+):c(Mg2+):c(Cl-)=1:1:5(不考虑离子的水解) |
| C、NaOH和盐酸的分界点是6mL处 |
| D、从7到9,都发生离子反应H++OH-→H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苏打-NaHCO3 |
| B、胆矾-CuSO4 |
| C、酒精-CH3OH |
| D、生石灰-CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2mol/L |
| B、0.1mol/L |
| C、0.05mol/L |
| D、0.4mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com