
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变不同 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
分析 A.反应自发进行的判断依据是△H-T△S<0;
B.FeCl3和MnO2均可加快H2O2分解,但催化机理不同,反应速率不同;
C.反应是放热反应,升温平衡逆向进行;
D.升温平衡向吸热方向进行;
解答 解:A.CaCO3(s)═CaO(s)+CO2(g)室温下不能自发进行,反应△S>0,△H-T△S>0,说明该反应的△H>0,故A错误;
B.FeCl3和MnO2均可加快H2O2分解,但催化机理不同,反应速率不同;同等条件下二者对H2O2分解速率的改变不同,故B正确;
C.N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,平衡逆向进行,反应速率V(H2)增大,氢气的平衡转化率减小,故C错误;
D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是吸热过程,故D错误;
故选B.
点评 本题考查了化学反应能量变化、反应焓变意义、催化剂作用、影响化学平衡因素分析判断等知识,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
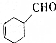 $→_{催化剂}^{H_{2}(足量)}$A$\stackrel{HBr}{→}$B$→_{干醚}^{Mg}$
$→_{催化剂}^{H_{2}(足量)}$A$\stackrel{HBr}{→}$B$→_{干醚}^{Mg}$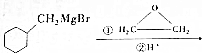 C$→_{Cu,△}^{O_{2}}$
C$→_{Cu,△}^{O_{2}}$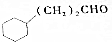 $→_{H+}^{KMnO_{4}}$D$→_{浓H_{2}SO_{4},△}^{E}$
$→_{H+}^{KMnO_{4}}$D$→_{浓H_{2}SO_{4},△}^{E}$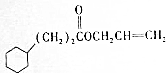
 RCH2CH2OH+
RCH2CH2OH+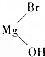
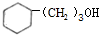 .
. 的化学方程式2
的化学方程式2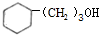 +O2$\stackrel{Cu}{→}$
+O2$\stackrel{Cu}{→}$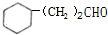 +2H2O,反应类型为氧化反应.
+2H2O,反应类型为氧化反应. ,反应类型为酯化反应.
,反应类型为酯化反应. ,名称为丙酮.
,名称为丙酮.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铍(Be)的原子失电子能力比镁弱 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强 | |
| D. | 硒(Se)化氢比硫化氢稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
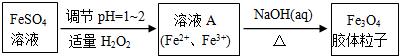
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe2+ | 5.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤燃烧是热能转化为化学能的过程 | |
| B. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| C. | 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 | |
| D. | 化石燃料属于一次能源,电能属于二次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氢键存在于分子之间,不存在于分子之内 | |
| B. | 对于组成和结构相似的分子,其范德华力随着相对分子质量的增大而增大 | |
| C. | NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子 | |
| D. | 冰熔化时只破坏分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
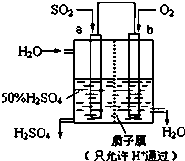
| A. | a为负极,b为正极 | |
| B. | b电极发生氧化反应 | |
| C. | H+从a极向b极移动 | |
| D. | 负极反应式为:SO2+2H2O-2e-=SO42-+4H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com