
绿矾(FeSO4·7H2O)、硫酸亚铁铵(FeSO4·(NH4 )2SO4·6H2O)是重要的化学化工试剂。工业上常利用机械加工行业产生的废铁屑为原料制备。
图Ⅰ 图Ⅱ
请回答下列问题:
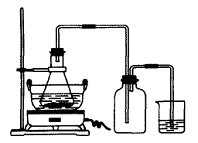
(1)图Ⅰ用于制备绿矾。其中锥形瓶中盛放的药品或原料是__________,集气瓶的作用是__________;烧杯中主要发生:①CuSO4+H2S=CuS↓+H2SO4 ②4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu↓,则烧杯中盛放的试剂是___ ___,其作用是_______________。
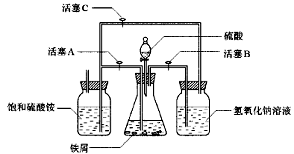
(2)图Ⅱ用于制备硫酸亚铁铵。在0~60℃的温度范围内,硫酸亚铁铵在水中的溶解度比硫酸铵、硫酸亚铁的溶解度小,冷却混合液至室温便析出硫酸亚铁铵。具体操作:①打开活塞____________,关闭活塞_________,从分液漏斗滴入6 mol·L-1 H2SO4到250 mL锥形瓶,充分反应。②待锥形瓶中的铁屑快反应完时,关闭活塞________,打开活塞________。③放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵。
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化。设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁铵,并对产品质量进行检测。检测结果如下:
| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
已知产品质量标准:Fe3+的质量分数等于0.005%,产品质量定为Ⅰ级;Fe3+的质量分数等于0.01%,产品质量定为Ⅱ级,从实验结果中,可得出制备硫酸亚铁溶液时,反应控制___________过量为最佳。
(1)铁屑、稀硫酸;安全瓶作用,防止烧杯中的洗液倒吸至锥形瓶中污染产物;CuSO4溶液;吸收H2S、PH3等尾气。
(2)BC,A;BC(或B),A
(3)铁
(1)根据提示方程式,可以推知尾气中当含有H2S、PH3等,烧杯里盛放硫酸铜溶液。
(2)本题利用产生的气体所造成的压强的变化,将锥形瓶中产生的硫酸亚铁溶液挤压进入硫酸铵溶液以制备硫酸亚铁铵。考虑到亚铁离子的强还原性,故需要保证析出时处于一个还原性的保护气氛下,铁和硫酸反应放出的氢气恰可实现该目的。故开始时需要通过活塞的打开、关闭的选择让氢气进入硫酸铵溶液的试剂瓶,然后让氢气在锥形瓶中聚集增大压强以将硫酸亚铁溶液挤压进入硫酸铵溶液。


科目:高中化学 来源: 题型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
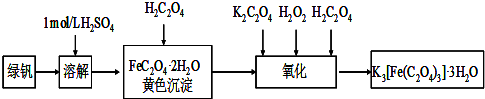
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 4 |
| O | 2- 7 |
| O | 2- 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com