
| A. | Mg2+、Fe3+、SO42-、I- | B. | Fe2+、H+、Cl-、NO3- | ||
| C. | Na+、Fe3+、HCO3-、Cl- | D. | Mg2+、Fe3+、SO42-、Cl- |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层
X、Y、Z、W均为短周期元素,在周期表中位置如图所示.Y原子的最外层电于数是内层| A. | 气态氢化物的稳定性:Y>Z | |
| B. | 最高价氧化物物对应水化物酸性:Z>W | |
| C. | X的气态氢化物与Y、Z、W的气态氢化物都可以反应 | |
| D. | 气态氢化物的沸点,Y最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 温度 物质的量 时间 | 2min | 4min | 6min | 8min | 10min | 12min |
| 450℃ | 0.2mol | 0.3mol | 0.35mol | 0.40mol | 0.50mol | 0.50mol |
| 480℃ | 0.25mol | 0.35mol | 0.45mol | 0.60mol | 0.60mol | 0.60mol |
| A. | 该反应是熵增,焓增的反应,在较高温度下能自发进行 | |
| B. | 恒温恒压,达到新平衡时,c(CO2)不变,c(MgCO3)增大 | |
| C. | 在2~8min之间CO2平均速率v(CO2)=$\frac{1}{30}$mol•L-1•min-1 | |
| D. | 升高温度,该反应平衡常数、分解速率和MgCO3分解率都增大. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、K+、Cl-、SO42- | B. | K+、H+、Cl-、OH- | ||
| C. | K+、Ag+、Br-、NO3- | D. | Na+、K+、SO42-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
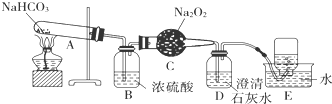
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容器 编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
| CO | H2O | CO2 | H2 | |||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2(SO2):饱和碳酸氢钠溶液 | B. | N2(O2):灼热的铜网 | ||
| C. | Al2O3(SiO2):NaOH溶液 | D. | Na2CO3固体(NaHCO3):加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com