
| A. | 温室效应--减少化石燃料使用,开发清洁能源 | |
| B. | 土壤污染--科学灌溉,合理使用农药和化肥 | |
| C. | 白色污染--杜绝生产塑料袋,从根源上治理 | |
| D. | 水体污染--节约用水,减少污水排放 |
分析 A、二氧化碳是造成温室效应的主要气体;
B、过量使用化肥农药会污染水体和土壤,所以合理使用化肥和农药能减少土壤污染;
C、根据白色污染是由于塑料制品的任意丢弃引起的考虑;
D、节约用水和合理施用农药、化肥,可以减少水体污染;
解答 解:A、二氧化碳是造成温室效应的主要气体,所以可以通过减少化石燃料使用,开发清洁能源,从而减少二氧化碳的排放,故A正确;
B、过量使用化肥农药会污染水体和土壤,所以合理使用化肥和农药能减少土壤污染,故B正确;
C、白色污染是由于塑料制品的任意丢弃引起的,所以用布袋或纸袋代替塑料袋购物有利于减少白色污染,而不是杜绝生产塑料袋,故C错误;
D、节约用水和合理施用农药、化肥,可以减少水体污染,故D正确.
故选C.
点评 本题考查了常见的生活环境的污染和治理,运用化学知识解释生活现象,学以致用,难度不大.


科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向某盐溶液中加入AgNO3溶液,产生白色沉淀;加入浓NaOH溶液加热,生成使湿润红色石蕊试纸变蓝的气体 | 该盐一定是NH4Cl |
| B | 向浓硝酸中加入足量铜片充分反应,所得气体显红棕色 | 该气体是纯净的NO2 |
| C | 常温下,向浓度均为0.01mol/L的Na2CO3和Na2SO4的混合溶液中滴加1~2滴BaCl2溶液,滤出的沉淀不溶于盐酸 | 说明常温下Ksp(BaCO3)>Ksp(BaSO4) |
| D | 向Na2O2与水反应后所得溶液中加少量MnO2 | 检验Na2O2与水反应的中 间产物为H2O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示:
将一定质量的镁和铝的混合物投入200mL稀硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入的NaOH溶液体积的变化关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
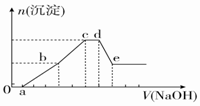 向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1mol•L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.下列有关说法正确的是( )
向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1mol•L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.下列有关说法正确的是( )| A. | 在0~a段加入的NaOH溶液与NH4Cl反应 | |
| B. | 在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3 | |
| C. | c点溶液中溶质只有NaCl | |
| D. | 在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温时,12g石墨晶体中所含六元环数目为NA | |
| B. | 标准状况下,18g D2O中所含电子数为9 NA | |
| C. | 1mol N2与 4mol H2反应生成的NH3分子数为2NA | |
| D. | 标准状况下,2.24L SO3中所含原子数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
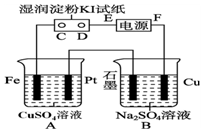 用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.
用如图所示的装置进行电解.通电一会儿,发现用NaCl溶液湿润的淀粉KI试纸的C端变为蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
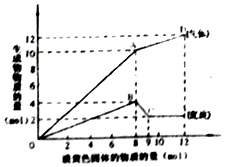 某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( )
某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种.当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系,如图所示.下列说法正确的是( )| A. | 溶液中一定含有Mg2+、NH4+、Al3+,可能含有Fe2+ | |
| B. | 图中A点产生的气体总质量为230克 | |
| C. | 图中A到D之间会产生有刺激性气味的气体 | |
| D. | 图中B到C之间发生的化学反应一定是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com