
| A、F2与I2 |
| B、HF与HCl |
| C、Na与K |
| D、NaCl与H2O |


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案科目:高中化学 来源: 题型:
| A、蒸发操作时,应使蒸发皿中的水分完全离干后,才能停止加热 |
| B、加入盐酸,放出无色气体,该气体能使澄清石灰水变浑浊的气体,则原溶液中有CO32- |
| C、除去铜粉中混有的少量镁粉和铝粉可加入足够稀盐酸,反应后过滤、洗涤 |
| D、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=12的1.0L NaClO溶液中水电离出的OH-的数目为0.01NA |
| B、等物质的量的N2和C0所含电子数均为NA |
| C、Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| D、在c(H+)水?c(OH-)水=10-26的溶液中能大量共存:K+、Fe2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
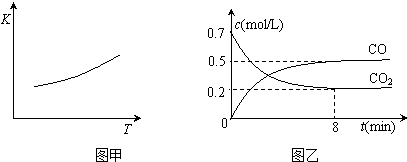
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、青霉素被誉为二战时期的三大发明之一 |
| B、运动员长期服用麻黄碱可提高成绩 |
| C、服用氢氧化钠溶液可中和过多的胃酸 |
| D、长期大量服用阿司匹林可预防感冒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Na2O和Na2O2的混合物中所含阴离子数为NA |
| B、1.7g H2O2中含有的电子数为0.9 NA |
| C、1 mol Na2O2与足量的CO2反应,电子转移数为2NA |
| D、标准状况下,2.24LCO2和CO中所含分子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
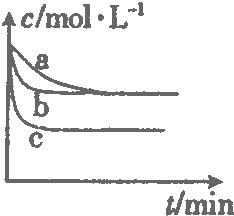 1000℃时,硫酸钠可与氢气发生反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).请回答下列问题:
1000℃时,硫酸钠可与氢气发生反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).请回答下列问题: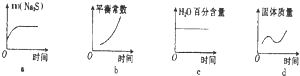
查看答案和解析>>
科目:高中化学 来源: 题型:
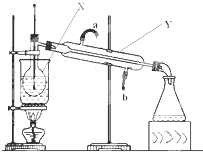 用NaOH固体配制100mL2.0mol/L NaOH溶液,其操作可以分为以下几步(容量瓶已检查完好,瓶口处不漏水):
用NaOH固体配制100mL2.0mol/L NaOH溶液,其操作可以分为以下几步(容量瓶已检查完好,瓶口处不漏水):查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com