
下列有关叙述正确的是()
A. 氢键是一种特殊化学键,它广泛地存在于自然界中
B. 在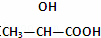 分子中含有1个手性C原子
分子中含有1个手性C原子
C. 碘单质在水溶液中溶解度很小是因为I2和H2O都是非极性分子
D. 含氧酸可用通式XOm(OH)n来表示,若n值越大,则含氧酸的酸性越大
考点: 含有氢键的物质;极性分子和非极性分子;常见有机化合物的结构.
专题: 化学键与晶体结构.
分析: A、氢键是一种分子间作用力,不是化学键;
B、一个碳原子与其它四个不同的原子或原子团相连的碳为手性C原子;
C、I2和是非极性分子而H2O是极性分子,非极性分子难溶于极性溶剂;
D、含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强.
解答: 解:A、氢键是一种分子间作用力,不是化学键,故A错误;
B、一个碳原子与其它四个不同的原子或原子团相连的碳为手性C原子,中间的碳为手性C原子,故B正确;
C、I2和是非极性分子而H2O是极性分子,非极性分子难溶于极性溶剂,相似相溶的所以碘单质在水溶液中溶解度很小,故C错误;
D、含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强,故D错误;
故选B.
点评: 本题考查分子间作用力和分子的极性、手性C原子,根据非羟基氧原子数目多少来确定酸性强弱即可,难度不大.


科目:高中化学 来源: 题型:
大气中的SO2是造成酸雨的主要污染物。最新研究表明,离子晶体[N(CH3)4]2 SO4(s) 能与SO2进行如下可逆反应,使其可能成为绿色的SO2吸收剂:[N(CH3)4]2 SO4(s)+ SO2(g) [N(CH3)4]2 S2O6(s)下列说法正确的是
[N(CH3)4]2 S2O6(s)下列说法正确的是
A.[N(CH3)4]+中只含共价键 B.该反应中,SO2作氧化剂
C.SO2漂白品红是利用其强氧化性 D.每吸收标准状况下的SO211.2L,生成15.4g[N(CH3)4]2 S2O6
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W四种短周期元素在周期表中相对位置如下表所示,Y是地壳中含量最高的元素。下列说法中不正确的是 ( )。
| X | Y | ||
| Z | W |
A.Z的原子半径大于Y
B.Y的非金属性强于W
C.W的氧化物对应的水化物都是强酸
D.X、Z的最高价氧化物均可与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是元素周期表中的一部分,表中所列字母分别代表一种化学元素,请回答下列问题:

(1)写出j在周期表中的位置__________。
(2)o、i、p三种元素之间能以原子个数之比1∶1两两形成互化物,这些互化物的性质类似于这些元素单质的性质。请写出i、p的互化物与f、l形成的化合物等物质的量反应时的化学方程式:_____________________________。
(3)假设NH 是“元素NH4”的阳离子,则“元素NH4”在周期表中的位置应该是______________;NH4的碳酸盐应________(填“易”或“不易”)溶于水。
是“元素NH4”的阳离子,则“元素NH4”在周期表中的位置应该是______________;NH4的碳酸盐应________(填“易”或“不易”)溶于水。
查看答案和解析>>
科目:高中化学 来源: 题型:
以NA表示阿伏加德罗常数,下列说法错误的是()
A. 1mol P4中P﹣P键的数目为6NA
B. 1mol Na2O2晶体中含有阴阳离子总数为4NA
C. 30g SiO2晶体中含有Si﹣O键数目为2NA
D. 6g金刚石中含有的碳碳键数目为1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是()
①具有规则几何外形的固体一定是晶体
②含有阳离子的晶体一定是离子晶体
③非极性分子中一定含有非极性键
④s﹣s σ键与s﹣p σ键的电子云形状相同
⑤含有共价键的晶体一定具有高的熔、沸点及硬度
⑥因为H﹣F的键能大于H﹣Cl的键能,所以HF的沸点高于HCl
⑦含有π键的化合物与只含σ键的化合物的化学性质不同
⑧中心原子采取sp3杂化的分子,其立体构形不一定是正四面体.
A. ①②⑤⑥ B. ③⑦⑧ C. ⑦⑧ D. ③④⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化,是通过取代反应来实现的是( )
|
| A. | CH3CH2OH→CH3CHO | B. | C2H4→C2H4Br2 |
|
| C. |
| D. | CH3CH2OH→CH2=CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com