
| A、①④ | B、②④ | C、①③ | D、②③ |
| 88 |
| 36 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
 A~G的转化关系如图所示(部分反应物、产物和反应条件未标出).
A~G的转化关系如图所示(部分反应物、产物和反应条件未标出).查看答案和解析>>
科目:高中化学 来源: 题型:
| 晶体 | NaCl | MgO | AlCl3 | SiCl4 | B(硼) |
| 熔点℃ | 801 | 2852 | 180 | -70 | 2300 |
| 沸点℃ | 1465 | --- | 177 | 57 | 2500 |
| A、晶体的沸点CCl4<SiCl4 |
| B、在火山喷出的岩浆,晶出顺序为MgO先于NaCl |
| C、用AlCl3通过电解法冶炼铝 |
| D、硼的硬度大,不溶于水,但能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、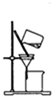 该图装置可以提纯精制氢氧化铁胶体 |
B、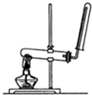 该图装置可以用来制备和收集氨气和氧气 |
C、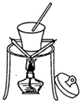 该图可以从食盐水中得到食盐晶体 |
D、 该图试管中放新制FeSO4溶液,从滴管中滴加NaOH溶液,易于观察到Fe(OH)2颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电池工作时,正极反应式为:O2+2 H2O+4e-=4OH- |
| B、忽略能量损耗,当电池中消耗0.02g H2时,a极周围会产生0.02g H2 |
| C、电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 |
| D、电解时,a 电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、向氯化铝溶液通入过量的氨气:Al3++4OH-═
| ||||
B、MnO2与浓盐酸反应制Cl2:MnO2+4HCl
| ||||
| C、FeCl3溶液用于蚀刻印刷电路:Cu+2Fe3+=Cu2++2Fe2+ | ||||
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2 与水反应:2O22-+2H2O=4OH-+O2↑ |
| B、NaHCO3与盐酸:CO32-+2H+=H2O+CO2↑ |
| C、Ca(HCO3)2与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| D、醋酸与小苏打溶液反应H++HCO3-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4:25 | B、2:17 |
| C、1:7 | D、3:8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com