
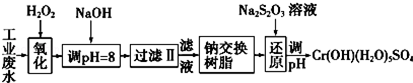
分析 (1)①为氯气通入到富含溴离子的海水中,把溴置换出来;③为用硫酸酸化,即可得到溴单质;
(2)用SO2吸收溴,发生氧化还原反应生成硫酸和HBr;
(3)用于海水中溴的萃取,选择与溴不反应,不溶于水的有机溶剂.
解答 解:(1)①为氯气通入到富含溴离子的海水中,把溴置换出来,离子反应为Cl2+2Br-═2Cl-+Br2;
③为用硫酸酸化,即可得到溴单质,离子反应为BrO3-+5Br-+6H+═3Br2+3H2O,
故答案为:Cl2+2Br-═2Cl-+Br2;BrO3-+5Br-+6H+═3Br2+3H2O;
(2)用SO2吸收溴,发生氧化还原反应生成硫酸和HBr,化学反应为Br2+SO2+2H2O═2HBr+H2SO4,
故答案为:Br2+SO2+2H2O═2HBr+H2SO4;
(3)用于海水中溴的萃取,选择与溴不反应,不溶于水的有机溶剂,而乙醇与水互溶,四氯化碳、对二甲苯均可作萃取剂,故答案为:②③.
点评 本题考查海水资源的综合应用,为高频考点,把握混合物分离方法、物质的性质及发生的反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
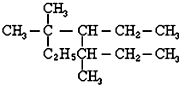 的名称是3,3,5-三甲基-4-乙基庚烷.
的名称是3,3,5-三甲基-4-乙基庚烷.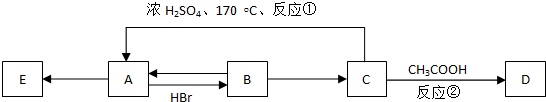
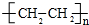 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
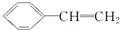 )有下列叙述:
)有下列叙述:| A. | ①②③④⑤ | B. | ①②⑤⑥ | C. | ①②④⑤⑥ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实 验 操 作 | 结 论 |
| A | 用容量瓶配制溶液时,若定容摇匀后液面低于刻度线,补加水至与刻度线相平 | 所配溶液浓度不受影响 |
| B | 用湿润的pH试纸测定氯水的pH | 所测溶液的pH偏大 |
| C | 取少量试液于试管中,加入浓NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 | 若红色石蕊试纸变蓝 则所取溶液含NH4+ |
| D | 用托盘天平称取一定质量的NaCl固体,左盘放砝码,右盘放固体 | 所称NaCl质量一定偏小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:Al(OH)3、Mg(OH)2、NaOH | B. | 酸性:HClO4、H2SO4、H3PO4 | ||
| C. | 还原性:HCl、HBr、HI | D. | 原子半径:S、Na、O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气分子内每个氢原子都达到了8电子稳定结构 | |
| B. | 1 mol H2的能量比2 mol H的能量低 | |
| C. | 1 mol H2离解成2 mol H要放出437.6 kJ热量 | |
| D. | 氢原子不如氢分子活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com