
| A. | Na2O、MgO、Fe3O4均为金属氧化物,并且都是碱性氧化物 | |
| B. | CH3COONa、CuSO4、NaOH、H2S水溶液均能导电,并且都是强电解质 | |
| C. | 赤铁矿、磁铁矿、黄铁矿、孔雀石都含有铁元素,并且都是常见的铁矿石 | |
| D. | HClO、H2SO4、HNO3均具有氧化性,并且都是氧化性酸 |
科目:高中化学 来源: 题型:选择题
| A. | 1.5g甲基(-CH3)所含有的电子数是9NA | |
| B. | 标准状况下,11.2L四氯化碳所含分子数为0.5 NA | |
| C. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为5/22.4 NA | |
| D. | 常温常压下,1mol丙烷所含有的共价键数目为12NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5 g 98%的硫酸(密度为1.84 g/cm3)与5 mL 18.4 mol/L硫酸的浓度是不同的 | |
| B. | 制成0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L(标准状况) | |
| C. | 0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023 | |
| D. | 从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向含nmolNH4Al(SO4)2的溶液中,逐滴加入含nmolNaOH的溶液:Al3++3OH-═Al(OH)3↓ | |
| B. | 向NaAlO2溶液中通入足量CO2气体:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 向溴水中通入SO2气体:SO2+Br2+2H2O═2H++SO42-+2HBr | |
| D. | 含2nmolNaOH的溶液和含nmolCa(HCO3)2的溶液混合OH-+Ca2++HCO3-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
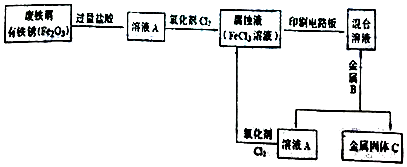
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 压缩容器体积 | B. | 降温 | ||
| C. | 增大C(s)的量 | D. | 恒温恒压时加入一定量H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
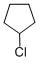 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$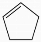 +NaCl+H2O.
+NaCl+H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
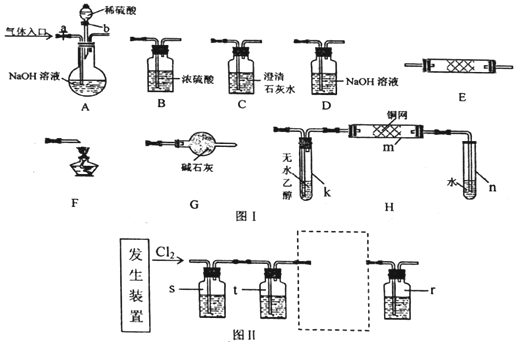
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
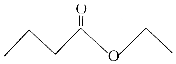 茅台酒中存在少量具有凤梨香味的物质X,其结构如图所示,下列说法正确的是( )
茅台酒中存在少量具有凤梨香味的物质X,其结构如图所示,下列说法正确的是( )| A. | X难溶于乙醇 | |
| B. | X的分子式为C6H10O2 | |
| C. | 酒中的少量丁酸能抑制X的水解 | |
| D. | 分子式为C4H8O2且官能团与X相同的物质共有5种(不考虑立体结构) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com