
| A. | Mg | B. | SO2 | C. | Zn2+ | D. | Cl- |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 制备氯气时严格检查装置的气密性,并设置尾气吸收装置 | |
| B. | 稀释浓硫酸时,将水倒入浓硫酸中,使用玻璃棒不断搅拌 | |
| C. | 在敞口容器中进行铜与浓硝酸的反应,并观察生成的气体 | |
| D. | 向一支试管中加入少量水,向其中投入一块黄豆大小的钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①④⑥ | C. | ②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为:
乙酰苯胺是一种白色有光泽片状结晶或白色结晶粉末,是磺胺类药物的原料,可用作止痛剂、退热剂、防腐剂和染料中间体.乙酰苯胺的制备原理为: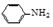 +CH3COOH?
+CH3COOH?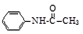 +H2O
+H2O| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 | |
| 苯 胺 | 93 | 无色油状液体,具有还原性 | 1.00 | 184.4 | 微溶于水 | 易溶于乙醇、乙醚等 |
| 乙 酸 | 60 | 无色液体 | 1.05 | 118.1 | 易溶于水 | 易溶于乙醇、乙醚 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水 | 易溶于乙醇、乙醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
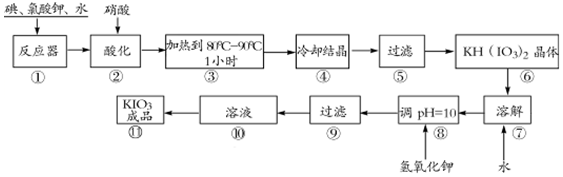
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高温度可以提高NO和CO的转化率 | |
| B. | 使用高效催化剂可以提高NO和CO的转化率 | |
| C. | 反应达到平衡后,NO 的生成速率和消耗速率相等 | |
| D. | 若该反应已达到平衡状态,增大压强(通过减小体积实现)对平衡无影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热反应一定需要加热才能发生 | |
| B. | 放热反应一定不需要加热就能进行 | |
| C. | 放热反应中,反应物的键能总和大于生成物的键能总和 | |
| D. | 吸热反应中,反应物的总能量小于生成物的总能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com