
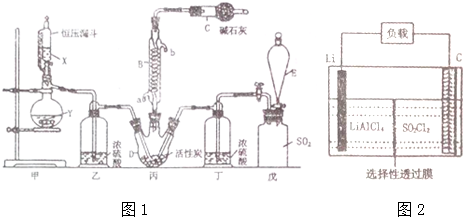
分析 本题利用实验室制得的氯气和SO2在木炭作催化剂的作用下合成SO2Cl2,因SO2Cl2是一种无色液体,极易水解生成硫酸和盐酸,遇潮湿空气会产生白雾,因此要保证参加反应的氯气和SO2是干燥的,同时要防止空气中的水汽进入三颈瓶中,为了减小生成物的损失需要使用冷凝管冷凝回流,同时要利用碱石灰吸收SO2和氯气的尾气防污染,反应后的液体混合物可利用蒸馏进行分离,据此分析作答;
(1)化合物SO2Cl2中O元素为-2价、Cl元素为-1价,根据化合价规则计算S元素的化合价;
(2)结合常见的仪器,可命名仪器D;因SO2Cl2易水解,应防止水进入反应容器中;
(3)戊是储存SO2的装置,可以通过E中滴加的溶液排出SO2气体,因此此溶液不能溶解SO2;装置乙和丁的装置均为干燥装置,防止SO2Cl2的水解;
(4)相互混溶的液体混合物可以根据沸点差异进行分离;
(5)装置甲是制备Cl2的,催化剂可以改变反应速率,蒸馏操作应在蒸馏烧瓶中进行,冷凝管仅是冷却蒸汽的;
(6)正极是SO2Cl2中+6价的硫得电子发生还原反应.
解答 解:利用实验室制得的氯气和SO2在木炭作催化剂的作用下合成SO2Cl2,因SO2Cl2是一种无色液体,极易水解生成硫酸和盐酸,遇潮湿空气会产生白雾,因此要保证参加反应的氯气和SO2是干燥的,同时要防止空气中的水汽进入三颈瓶中,为了减小生成物的损失需要使用冷凝管冷凝回流,同时要利用碱石灰吸收SO2和氯气的尾气防污染,反应后的液体混合物可利用蒸馏进行分离,据此分析作答;
(1)化合物SO2Cl2中O元素为-2价、Cl元素为-1价,令S元素化合价为x,根据化合价规则x+2×(-2)-1=0,故x=6,即S元素的化合价为+6,
故答案为:+6;
(2)仪器D是三颈瓶,C中碱石灰除吸收含有氯气和二氧化硫的尾气,还可以防止水进入三颈瓶中,避免SO2Cl2水解,故答案为:三颈瓶;防止空气中的水进入三颈瓶;
(3)通过E中的溶液排出戊中SO2,因此可选择饱和亚硫酸氢钠溶液;若没有乙和丁的干燥装置,会有水进入三颈瓶中,发生SO2Cl2的水解,反应方程式为SO2Cl2+2H2O=2HCl+H2SO4,
故答案为:饱和亚硫酸氢钠溶液;SO2Cl2+2H2O=2HCl+H2SO4;
(4)可利用蒸馏操作分离相互混溶的液体混合物,故答案为:蒸馏;
(5)a、铜片和浓硫酸在加热条件下只能生成SO2,而甲装置是制Cl2的,应该是浓盐酸和高锰酸钾固体,故错误;
b、可选择活性炭催化SO2和Cl2的反应,故b正确;
c、冷凝管B只起冷凝作用,蒸馏操作应在蒸馏烧瓶内进行,故c错误;
故选b;
(6)正极是SO2Cl2中+6价的硫得电子发生还原反应,所以电极反应式为:SO2Cl2+2e-=2Cl-+SO2↑,
故答案为:SO2Cl2+2e-=2Cl-+SO2↑.
点评 本题考查化学制备实验、对装置与操作的分析评价、对信息获取及应用和电极反应式的书写等,关键是明确原理,需要学生具备扎实的基础与灵活运用的能力,难度中等.


科目:高中化学 来源: 题型:选择题
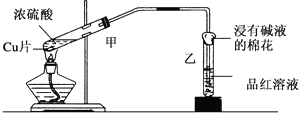
| A. | 甲试管内溶液变为蓝色 | |
| B. | 乙试管中品红溶液红色褪去 | |
| C. | 棉花上喷入的溶液可能为氢氧化钠溶液 | |
| D. | 棉花上喷入的溶液可能为饱和碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2W-+Z2═W2+2Z- | B. | 2Y-+W2═Y2+2W- | C. | 2Z-+X2═Z2+2X- | D. | 2X-+Y2═X2+2Y- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 名 称 | 抑酸成分 | 主要成分含量/片 |
| ① | INDICALM | CaCO3 | 250mg |
| ② | Stamachease | Al(OH)3 | 250mg |
| ③ | Fash digestion | MgO | 250mg |
| A. | ①=②=③ | B. | ①>②>③ | C. | ③>②>① | D. | ②>③>① |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
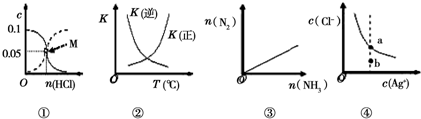
| A. | 图①表示室温下,用0.1 mol•L-1的氨水吸收HCl气体时,溶液中的粒子浓度随HCl体积的变化.实现表示c(NH3•H2O),虚线表示c(NH4+),处于M点时溶液呈中性 | |
| B. | 图②表示2SO2(g)+O2(g)?2SO3(g)△H<0,正逆反应的平衡常数随温度的变化 | |
| C. | 图③表示2NH3(g)?N2(g)+3H2(g),在恒温恒压的密闭容器中达平衡时N2的物质的量随的 NH3物质的量的变化 | |
| D. | 图④表示AgCl(s)?Ag+(aq)+Cl-(aq)的离子浓度关系,当处于b点时,蒸发部分水后,可到达平衡线的a点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯分子中的6个碳原子之间的键完全相同,是一种介于碳碳单键和碳碳双键之间的独特的键 | |
| B. | 将溴水加入苯中,溴水的颜色变浅,这是由于发生了加成反应 | |
| C. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O | |
| D. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com