


科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
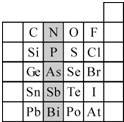 (1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
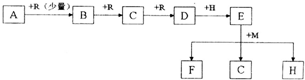
| ||
| ||
| ||
| ||
| 20V |
| 7 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作与实验目的相符的是( )
|
查看答案和解析>>
科目:高中化学 来源:2014届四川省邛崃市高三第一次月考理综化学试卷(解析版) 题型:选择题
下列实验操作与实验目的相符的是( )
序号 实验操作 实验目的
A 测定HF、HCl的熔点、沸点 比较F、Cl的非金属性强弱
B MgSO4、Al2(SO4)3溶液中分别滴加足量氨水 比较镁、铝的金属性强弱
C 将SO2气体通入碳酸钠溶液中 比较碳、硫的非金属性强弱
D 向氯化铵、氯化铝混合溶液中,滴加氢氧化钠溶液至过量 比较NaOH、NH3·H2O、Al(OH)3的碱性强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com