
| ĪļÖŹ | CO | H2 | CH3OH |
| ÅØ¶Č£Ømol•L-1£© | 0.9 | 1.0 | 0.6 |
·ÖĪö £Ø1£©æÉÄę·“Ó¦µ½“ļĘ½ŗāŹ±£¬Ķ¬ÖÖĪļÖŹµÄÕżÄęĖŁĀŹĻąµČĒŅ±£³Ö²»±ä£¬ø÷×é·ÖµÄÅØ¶Č”¢ŗ¬Įæ±£³Ö²»±ä£¬ÓÉ“ĖŃÜÉśµÄĘäĖüŅ»Š©Įæ²»±ä£¬ÅŠ¶ĻĘ½ŗāµÄĪļĄķĮæÓ¦Ėę·“Ó¦½ųŠŠ·¢Éś±ä»Æ£¬øĆĪļĄķĮæÓɱä»Æµ½²»ŌŁ±ä»ÆĖµĆ÷µ½“ļĘ½ŗā£»
£Ø2£©¢Łøł¾ŻK=$\frac{c£ØC{H}_{3}OH£©}{c£ØCO£©”Į{c}^{2}£Ø{H}_{2}£©}$¼ĘĖćĘ½ŗā³£Źż£»
¢Ś½µµĶĪĀ¶Č£¬KÖµŌö“ó£¬ĖµĆ÷½µµĶĪĀ¶ČĘ½ŗāĻņÕżĻņŅĘ¶Æ£¬ÕżĻņŹĒ·ÅČČ·“Ó¦£»
¢Ū¼ĘĖćÅضČÉĢQc£¬ČōQc=K£¬“¦ÓŚĘ½ŗāדĢ¬£¬ČōQc£¼K£¬·“Ó¦ĻņÕż·“Ó¦½ųŠŠ£¬ČōQc£¾K£¬·“Ó¦ĻņÄę·“Ó¦½ųŠŠ£¬½ų¶ųÅŠ¶ĻvÕż”¢vÄęĻą¶Ō“󊔣®
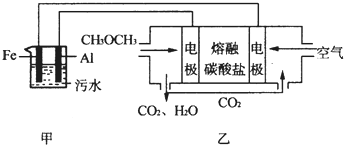
½ā“š ½ā£ŗ£Ø1£©a£®øĆ·“Ó¦Į½±ßµÄ»Æѧ¼ĘĮæŹż²»ĻąµČ£¬ŌŚ·“Ӧƻӊ“ļµ½Ę½ŗāŹ±£¬ĘųĢåµÄĪļÖŹµÄĮæ»į·¢Éśøı䣬ĢåĻµµÄŃ¹ĒæŅ²ŅŖøı䣬Čē¹ūŃ¹Ēæ²»±äĖµĆ÷ĘųĢåµÄÉś³ÉŗĶĻūŗÄĖŁĀŹĻąµČ£¬·“Ó¦“ļµ½ĮĖĘ½ŗā£¬¹ŹaÕżČ·£»
b£®·“Ó¦ÖŠNO2ŹĒÓŠÉ«ĘųĢ壬ŃÕÉ«²»±äĖµĆ÷NO2µÄÅØ¶Č²»ŌŁøı䣬Ōņ·“Ó¦“ļµ½ĮĖĘ½ŗā£¬¹ŹbÕżČ·£»
c£®NOŗĶO2µÄĘšŹ¼ĪļÖŹµÄĮæĻąµČ£¬µ«»Æѧ¼ĘĮæŹż²»Ķ¬£¬±ä»ÆĮæ¾Ķ²»ĻąĶ¬£¬Čē¹ūƻӊ“ļµ½Ę½ŗā£¬NOŗĶO2 µÄĪļÖŹµÄĮæÖ®±Č»į·¢Éśøı䣬²»·¢ÉśøıäĖµĆ÷µ½“ļĮĖĘ½ŗā£¬¹ŹcÕżČ·£»
d£® O2 ŹĒ·“Ó¦Īļ£¬NO2ŹĒÉś³ÉĪļ£¬²»¹ÜŌŚČĪŗĪŹ±ŗņ¶¼ÓŠĆæĻūŗÄ1 molO2Ķ¬Ź±Éś³É2 molNO2£¬¹Źd“ķĪó£¬
¹ŹŃ”£ŗabc£»
£Ø2£©¢ŁĘ½ŗā³£ŹżK=$\frac{c£ØC{H}_{3}OH£©}{c£ØCO£©”Į{c}^{2}£Ø{H}_{2}£©}$=$\frac{0.6}{0.9”Į{1}^{2}}$=$\frac{2}{3}$£¬¹Ź“š°øĪŖ£ŗ$\frac{2}{3}$£»
¢Ś½µµĶĪĀ¶Č£¬KÖµŌö“ó£¬ĖµĆ÷½µµĶĪĀ¶ČĘ½ŗāĻņÕżĻņŅĘ¶Æ£¬ÕżĻņŹĒ·ÅČČ·“Ó¦£¬¹Ź”÷H£¼0£¬¹Ź“š°øĪŖ£ŗ£¼£»
¢ŪÅضČÉĢQc=$\frac{0.6+\frac{0.4}{2}}{£Ø0.9+\frac{0.6}{2}£©”Į{1}^{2}}$=$\frac{2}{3}$=K£¬“¦ÓŚĘ½ŗāדĢ¬£¬ŌņvÕż=vÄę£¬¹Ź“š°øĪŖ£ŗ=£®
µćĘĄ ±¾Ģāæ¼²é»ÆŃ§Ę½ŗāדĢ¬µÄÅŠ¶Ļ”¢Ę½ŗā³£ŹżµÄ¼ĘĖćÓėÓ¦ÓĆµČ£¬×¢ŅāÅŠ¶ĻĘ½ŗāµÄĪļĄķĮæÓ¦Ėę·“Ó¦½ųŠŠ·¢Éś±ä»Æ£¬øĆĪļĄķĮæÓɱä»Æµ½²»ŌŁ±ä»ÆĖµĆ÷µ½“ļĘ½ŗā£®


 ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø
ĢģĢģĻņÉĻŅ»±¾ŗĆ¾ķĻµĮŠ“š°ø Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
Š”ѧɜ10·ÖÖÓÓ¦ÓĆĢāĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Al”ś[Al£ØOH£©4]- | B£® | Na2CO3”śNaOH | C£® | Al2O3”śAl£ØOH£©3 | D£® | Fe£ØOH£©2”śFe£ØOH£©3 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČČĪČ¶ØŠŌ£ŗNa2CO3£¾NaHCO3 | B£® | ĖįŠŌ£ŗH2CO3£¾H2SiO3 | ||
| C£® | ¼īŠŌ£ŗNaOH£¾LiOH | D£® | ČČĪČ¶ØŠŌ£ŗHF£¾HBr |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | æÉÓƵē½āČŪČŚCeO2ÖĘČ”½šŹōīę£¬īęŌŚŃō¼«Éś³É | |
| B£® | 58138Ce”¢58142CeŹĒĶ¬ĖŲŅģŠĪĢå | |
| C£® | īęÄÜČÜÓŚHIČÜŅŗ£¬·¢Éś·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗCe+4H+ØTCe4++2H2 | |
| D£® | īęµÄŌ×ÓŗĖĶāÓŠ58øöµē×Ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
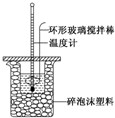 ijŹµŃ銔×éÓĆ0.50mol•L-1 NaOHČÜŅŗŗĶ0.50mol•L-1 ĮņĖįČÜŅŗ½ųŠŠ·“Ó¦ČČµÄ²ā¶Ø£¬ŹµŃé×°ÖĆČēĶ¼ĖłŹ¾£®
ijŹµŃ銔×éÓĆ0.50mol•L-1 NaOHČÜŅŗŗĶ0.50mol•L-1 ĮņĖįČÜŅŗ½ųŠŠ·“Ó¦ČČµÄ²ā¶Ø£¬ŹµŃé×°ÖĆČēĶ¼ĖłŹ¾£®| ĪĀ¶Č “ĪŹż | ĘšŹ¼ĪĀ¶Čt1/”ę | ÖÕÖ¹ĪĀ ¶Čt2/”ę | ĪĀ¶Č²ī Ę½¾łÖµ £Øt2-t1£©/”ę | ||
| H2SO4 | NaOH | Ę½¾łÖµ | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® |  ŻĶČ”Ź±Õńµ“·ÖŅŗĀ©¶· | B£® |  µē½ā¾«Į¶Ķ | ||
| C£® |  ĀĮČČ·“Ó¦ | D£® |  ŹµŃéŹŅÄ£ÄāŗĻ³É°± |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Mg£ØOH£©2[Al£ØOH£©3] | B£® | MgCl2£ØAlCl3£© | C£® | Mg£ØAl£© | D£® | MgO£ØAl2O3£© |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com