
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:
 CO2(g)+3H2(g)
CO2(g)+3H2(g)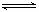 CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
CH3OH(g)+H2O(g) △H=-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如右图所示。
①能说明该反应已达平衡状态的是 。
A. CO2的体积分数在混合气体中保持不变
B. 混合气体的平均相对分子质量不随时间的变化而变化
C. 单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D. 反应中H2O与CH3OH的物质的量浓度之比为1:1,且 保持不变
②下列措施中能使 增大的是 (选填编号)。
增大的是 (选填编号)。
A.升高温度 B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离 D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K= 。若改变条件 (填选项),可使K=1。
A.增大压强 B.增大反应物浓度
C.降低温度 D.升高温度 E.加入催化剂
(2)某甲醇燃料电池原理如图1所示。

①M区发生反应的电极反应式为 。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为
(忽略溶液体积变化)。
(3) 有一种用CO2生产甲醇燃料的方法:
已知: CO2(g)+3H2(g)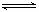 CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为: 。
【知识点】化学平衡的判断与移动、平衡常数的应用、电化学、盖斯定律
【答案解析】(共15分,除注明外其余每空各2分)
(1)①AB ②CD ③0.20或 C
C
(2)①CH3OH-6e-+H2O=CO2+6H+ ②0.16g
(3)CH3OH(l) + O2(g) =CO2(g) +2H2O(l) ΔH=-(
O2(g) =CO2(g) +2H2O(l) ΔH=-( c+2d-a-b)kJ·mol-1 (3分)
c+2d-a-b)kJ·mol-1 (3分)
解析:(1)①各组分的百分含量不再改变能说明该反应已达平衡状态,A正确;平均相对分子质量数值上等于总质量比上总物质的量,平均相对分子质量不随时间的变化而变化说明总物质的量不变,此反应为非等体反应,B正确;单位时间内每消耗1.2mol H2同时生成0.4molH2O,说的都是正反应速率,C项错误;反应中H2O与CH3OH均是生成物且计量数数之比是1:1,所以二者的物质的量浓度之比为1:1,且保持不变不能判定平衡,D错误;
②A、正向反应放热,升高温度,逆向移动,比值减小,故A错误;B、恒温恒容下充入He(g),反应中各物质的浓度保持不变,平衡不移动,比值不变,故B错误;C、将H2O(g)从体系中分离减小生成物浓度,平衡正向移动,比值增大,故C正确; D、恒温恒容再充入2 mol CO2和3 mol H2,相当于对原平衡增大压强,正向移动,比值增大,故D正确。
CO2(g)+3H2(g)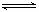 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度(mol/L) 1 1.5 0 0
变化浓度(mol/L) 0.25 0.75 0.25 0.25
平衡浓度(mol/L) 0.75 0.75 0.25 0.25
则:K=C(CH3OH)C(H2O)/C(CO2)C3(H2)= 0.20或 ;
;
要使K=1,应该正向移动,而K值只于温度有关,所以,降低温度,正向移动可以使K=1,选C
(2)①原电池中电解质阳离子往正极移动,故M处电极是负极,燃料电池的燃料作负极,故M区发生反应的电极反应式为:CH3OH-6e-+H2O=CO2+6H+
②用惰性电极,电解饱和食盐水总的电极反应式为2Cl-+2H2O H2↑+Cl2↑+2 OH-,pH值变为13时, C(OH-)=10-1mol/L,n(OH-)=10-1mol/L×300mL×10-3L/mL=0.03mol,由方程式CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O
H2↑+Cl2↑+2 OH-,pH值变为13时, C(OH-)=10-1mol/L,n(OH-)=10-1mol/L×300mL×10-3L/mL=0.03mol,由方程式CH3OH-6e-+H2O=CO2+6H+,2Cl-+2H2O H2↑+Cl2↑+2 OH-
H2↑+Cl2↑+2 OH-
可知 CH3OH~6e-~6OH-
32g 6mol
m(CH3OH) 0.03mol 则:m(CH3OH)=32g×0.03mol÷6mol=0.16g;
(3)应用盖斯定律解题,CH3OH(l) + O2(g) =CO2(g) +2H2O(l) ΔH=-(
O2(g) =CO2(g) +2H2O(l) ΔH=-( c+2d-a-b)kJ·mol-1
c+2d-a-b)kJ·mol-1
【思路点拨】本题考查了化学平衡的有关知识,电极反应式的书写,以及盖斯定律的应用,综合性强,但难度不大。


科目:高中化学 来源: 题型:
(1)一定条件下,发生反应CO(g)+H2O(g)  CO2(g)+H2(g),向2 L密闭容器中通入2 mol CO(g)、1 mol H2O(g),2 min 后反应达到平衡时,测得CO的物质的量为1.6 mol,用H2O(g)表示该反应速率为 ,此温度下,该反应的平衡常数为 。若往容器中再加入2 mol CO(g),则重新
CO2(g)+H2(g),向2 L密闭容器中通入2 mol CO(g)、1 mol H2O(g),2 min 后反应达到平衡时,测得CO的物质的量为1.6 mol,用H2O(g)表示该反应速率为 ,此温度下,该反应的平衡常数为 。若往容器中再加入2 mol CO(g),则重新 达到平衡时的CO总转化率
达到平衡时的CO总转化率
20%(填“>”、“<”或“=”)。
(2)在一密闭容器中发生反应2NO2 2NO+O2 ΔH>0,反应
2NO+O2 ΔH>0,反应 过程中NO2的浓度随时间变化的情况如下图所示:
过程中NO2的浓度随时间变化的情况如下图所示:
若曲线A、B分别表示的是该反应在某不同条件 下的反应情况,则曲线B此条件可能是________(填“增大压强”、“减小压强”、“升高温度”、“降低温度”或“使
下的反应情况,则曲线B此条件可能是________(填“增大压强”、“减小压强”、“升高温度”、“降低温度”或“使 用催化剂”)。
用催化剂”)。
(3)一定温度下,在密闭容器中N2O5可发生下列反应:
①2N2O5(g)  4NO2(g)+O2(g) ②2NO2(g)
4NO2(g)+O2(g) ②2NO2(g)  2NO(g)+O2(g)
2NO(g)+O2(g)
若达平衡时,c(NO2)=0.6 mol·L-1,c(O2)=1.3 mol·L-1,则反应②中NO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O),是重要的化工产品和强氧化剂。工业制备红矾钠的流程如下:

(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2 。为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:
2CrO42-+2H+= Cr2O72-+H2O; 3CrO42-+4H+= Cr3O102-+2H2O
① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:
□Cr2O72-+□S2-+□H2O ——□Cr(OH)3+□S2O32-+□OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是
已知: ①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:
4OH— — 4e— == O2↑+2H2O
B. 为了提高Ni的产率,电解过程中需要控制废水pH
C. 电解过程中,B中NaCl溶液的物质的量浓度将不断减小
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
据悉,奥运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾。撞击时发生的化学方程式为:5KClO3 + 6P=3P2O5 + 5KCl ,则下列有关叙述正确的是 ( )
A.上述反应是复分解反应
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替
D.上述反应中消耗3molP时,转移电子的物质的量为30mol
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中,属干这种情况的是
①过量锌与18 mol/L的硫酸反应;
②过量氢气与少量氮气在催化剂存在下充分反应;
③浓盐酸与过量的MnO2反应;
④过量铜与浓硫酸反应;
⑤过量稀硝酸与银反应;
⑥过量稀硫酸与大块状石灰石反应。
A.②③④⑥ B.②③⑤ C.①④⑤ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.某酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a≤b-1
B.在滴酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的c (NH4+) = c(Cl-)
C.常温下,某硫酸溶液的pH=3,升高其温度,溶液pH增大
D.相同温度、相同体积、相同物质的量浓度的KI和KF溶液中,离子总数前者大于后者
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com