
【题目】化学与生产生活密切相关,下列有关说法中不正确的是
A. 酒精能使蛋白质变性,酒精纯度越高杀菌消毒效果越好
B. 酸雨以及光化学烟雾的形成通常都与氮的含氧化合物有关
C. 泡沫灭火器中用的是小苏打和硫酸铝
D. 金属焊接前常用NH4Cl溶液处理焊接处
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:
【题目】橙花叔醇是一种具有香气的有机化合物,可用于配制玫瑰型、紫丁香型等香精,其结构如图所示,下列相关说法正确的是

A. 橙花叔醇的分子式为C15H24O
B. 橙花叔醇能发生氧化、还原、取代、聚合等类型的反应
C. 橙花叔醇与钠和NaOH均能发生反应
D. 橙花叔醇的同分异构体中可能含有苯环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(H2C2O4)溶液与酸性KMnO4溶液反应时,溶液褪色总是先慢后快,某学习小组探究反应过程中使褪色加快的主要原因,过程如下:
【查阅资料】KMnO4溶液氧化H2C2O4的反应历程为:
![]()
【提出假设】假设1:该反应为放热反应
假设2:反应生成的Mn2+对该反应有催化作用
假设3:K+对该反应有催化作用
该小组同学未提出浓度使反应速率加快的假设,原因是 。
【设计、完成实验】(1)称取 g草酸晶体(H2C2O4·2H2O),配置500 mL 0.10 mol/L H2C2O4溶液。
①在上述过程中必须用到的2种定量仪器是托盘天平和 。
②下列操作会使所配溶液浓度偏低的是 (填下列选项的字母序号)。
A.称取草酸晶体时,将草酸晶体放在托盘天平右盘 |
B.定容时俯视刻度线 |
C.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水 |
D.摇匀后,发现溶液液面低于刻度线,立即用胶头滴管加水再定容 |
(2)完成探究,记录数据
实验 | 烧杯中所加试剂及用量(mL) | 控制条件 | 溶液褪色时间(s) | |||
0.10 mol/L | 等浓度 | H2O | 0.50 mol/L | |||
1 | 30 | 20 | 30 | 20 | 18 | |
2 | 30 | 20 | 30 | 20 | 水浴控制温度65 ℃ | 15 |
3 | 30 | 20 | 30 | 20 | 加入少量MnSO4固体 | 3.6 |
4 | 30 | 20 | x | 20 | 加入5 mL 0.10 mol/LK2SO4溶液 | 18 |
则x = ,假设2成立
(3)由于KMnO4能氧化水中有机物等因素,为配制好稳定的KMnO4溶液,其浓度需标定。取10.00 mL 0.10 mol/L H2C2O4溶液于锥形瓶中,加入10 mL 0.50 mol/L稀硫酸,用(2)中KMnO4溶液滴定至锥形瓶中恰好呈浅紫色,且半分钟不褪色,记录数据,平行三次实验,平均消耗KMnO4溶液40.00 mL,则草酸溶液与酸性KMnO4溶液反应的离子方程式为: 。上述实验中KMnO4溶液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:E是石油裂解气的主要成份,其产量可以用来衡量一个国家的石油化工发展水平,E在标准状况下的密度为1.25 g·L-1,D是一种具有香味的物质,各物质间的转化如下图所示(有的反应条件和产物已略去)。

请回答下列问题:
(1)化合物B的结构简式为 __________,E中官能团的名称为__________。
(2)写出反应①的化学方程式__________________,反应类型___________。
(3)列说法正确的是__________。
A.用新制氢氧化铜悬浊液可以区分有机物B、C和D
B.乙酸乙酯在H218O中水解,产物乙酸中将含有18O同位素
C.乙酸乙酯在氢氧化钠溶液中水解的反应,可称为皂化反应
D.通过分液乙酸乙酯和有机物A的混合物,可分离得到纯的乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的AgNO3溶液滴定50.00mL0.0500mol/LKC1溶液,以K2CrO4为指示剂,测得溶液中pCl=-1gc(C1-)、pAg=-1gc(Ag+)随加入AgNO3溶液的体积变化如图所示。已知:Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,溶液中离子浓度小于或等于1.0×10-5mol/L则沉淀完全,下列说法错误的是

A. Ag2CrO4沉淀一定不是白色
B. AgC1的溶度积常数Ksp数量级为10-10
C. Cl-恰好完全沉淀时,指示剂的浓度应维持在2.0×10-2mol/L
D. 加入50 mLAgNO3溶液后再加入1mL0.01mol/LH2SO4会产生新的沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下:
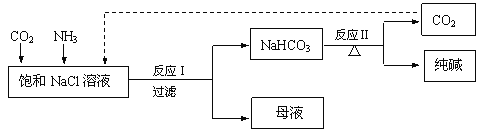
已知反应I为:NaCl + CO2 + NH3 + H2O === NaHCO3↓+ NH4Cl
(1)海水中含有大量的NaCl,以及少量的Ca2+、Mg2+、SO42等离子。
① 为得到纯净的饱和NaCl溶液,进行了如下操作。请补全操作步骤:
a.向浓缩后的海水中加入过量的氢氧化钠溶液后,过滤;
b.向滤液中加入过量___________________(填试剂名称),过滤;
c.向滤液中加入过量___________________(填试剂名称),过滤;
d.向滤液中加入足量的稀盐酸;
e.加热煮沸一段时间,得到饱和NaCl溶液。
② 步骤c中反应的离子方程式是______________________。
(2)反应II的化学方程式是_________________________。
(3)制得的纯碱中含有少量NaCl。取5.5 g纯碱样品加入足量稀硫酸,得到标准状况下1120 mL CO2。则样品中纯碱的质量分数是_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中甲为甲烷和O2构成的燃料电池示意图,电解质为KOH溶液,乙为电解饱和MgCl2溶液的装置,其中乙装置中X为阳离子交换膜。用该装置进行实验,反应开始后观察到Fe电极附近出现白色沉淀。下列说法正确的是

A. 甲、乙中电解质溶液的pH都增大
B. 理论上甲中每消耗22.4 L CH4(标准状况下),乙中产生4 mol Cl2
C. 乙中电解MgCl2溶液的总反应为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D. 甲中A处通入CH4,电极反应式为CH4+10OH--8e- =![]() +7H2O
+7H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com