
 (1)过氧化氢是一种二元弱酸,比碳酸的酸性还弱.
(1)过氧化氢是一种二元弱酸,比碳酸的酸性还弱.分析 (1)①二元弱酸分步电离,根据电离方程式的书写方法来回答;
②A.常温下,任何溶液中水的离子积是为一个定值;
B.加入少量氢氧化钠固体,根据氢氧根离子浓度对平衡移动的影响来回答;
C.加入少量浓盐酸,根据增加氢离子浓度对平衡移动的影响来回答;
D.氯化铁溶液为双氧水分解的催化剂.
(2)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小.
解答 解:(1)①H2O2属于二元弱酸,电离方程式为:H2O2=H++HO2-,HO2-=H++O22-,故答案为:H2O2=H++HO2-,HO2-=H++O22-;
②A.常温下,任何溶液中水的离子积是1.0×10-14,故正确;
B.加入少量氢氧化钠固体,消耗氢离子,过氧化氢的电离平衡正向移动,水的电离平衡逆向移动,故错误;
C.加入少量浓盐酸,增加氢离子浓度,所以过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动,故错误;
D.加入少量氯化铁溶液,会成为双氧水分解的催化剂,溶液中产生大量气泡,故正确,
故选AD;
(2)由图可知,稀释相同的倍数,HX的pH变化程度大,则酸性HX强,电离平衡常数大;稀释后,HX电离生成的c(H+)小,对水的电离抑制能力小,所以HX溶液中水电离出来的c(H+)大,
故答案为:大于;因为稀释相同倍数,HX的pH变化比CH3COOH大,即HX更易电离,所以HX电离平衡常数也大;小于;因为CH3COOH酸性弱于HX,稀释后CH3COOH溶液中c(H+)大于HX溶液中的c(H+),所以CH3COOH溶液对水的抑制能力强些.
点评 本题考查盐类水解及酸性的比较、pH与酸的稀释等知识,注意水解规律中越弱越水解和稀释中强的变化大来分析解答,综合性较大,题目难度中等.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:选择题
| A. | 上述反应中,S和KNO3是氧化剂,C是还原剂 | |
| B. | 上述反应中,每生成1 mollN2需转移6mol电子 | |
| C. | CO2的摩尔质量为44 g | |
| D. | 反应中的C若用石墨代替,石墨能导电,但属于非电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
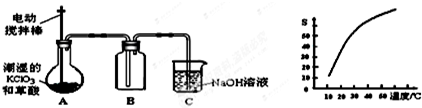
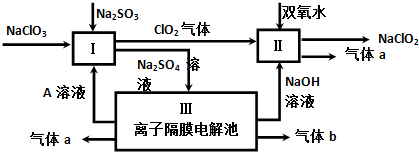
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 焓变是指1 mol物质参加反应时的能量变化 | |
| B. | 当反应放热时△H>0,反应吸热时△H<0 | |
| C. | 电能可以在水流的作用下产生,所以它属于一次能源 | |
| D. | 一个化学反应中,当反应物能量大于生成物能量时,反应放热,△H为“-” |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
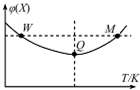 在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )
在2L恒容密闭容器中充入2mol X和1mol Y发生反应:2X(g)+Y(g)?3Z(g),反应过程持续升高温度,测得X的体积分数与温度的关系如图所示.下列推断正确的是( )| A. | Q点时,Y的转化率最大 | |
| B. | 升高温度,平衡常数增大 | |
| C. | W点X的正反应速率等于M点X的正反应速率 | |
| D. | 平衡时充入Z,达到新平衡时Z的体积分数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Ba2+、Ag+、Na+、Mg2+ |
| 阴离子 | NO3-、CO32-、OH-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com