
| A. | c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-) | |
| B. | c(HRO3-)+c(RO32-)+c(OH-)=c(H+)+c(Na+) | |
| C. | c(Na+)=c(HRO3-)+c(H2RO3)+c(RO32-) | |
| D. | 两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等 |
分析 NaHSO3溶液呈酸性,说明溶液中HSO3-电离程度大于水解程度,NaHCO3溶液呈碱性,说明HCO3-水解沉淀大于电离程度,
两溶液中发生的过程相似,①溶质电离:NaHRO3=Na++HRO3-,②HRO3-电离:HRO3-?H++RO32-,③HRO3-水解:HRO3-+H2O?H2RO3+OH-,④水电离:H2O?H++OH-;
由溶液呈电中性有电荷守恒关系(a):c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-);
据化学式NaHRO3得物料守恒关系(b):c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3);
(a)-(b)得质子守恒关系(c):c(H+)+c(H2RO3)=c(RO32-)+c(OH-);
对NaHSO3溶液,过程②的程度大于③,有c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-);
对NaHCO3溶液,过程③的程度大于②,有c(Na+)>c(HCO3-)>c(OH-)>c(CO32-)>c(H+);
同浓度的两溶液中,c(Na+)相等,c(HRO3-)不一定相等,c(SO32-)>c(CO32-).
解答 解:A.NaHSO3溶液呈酸性,说明溶液中HSO3-电离程度大于水解程度,c(H+)>c(OH-),NaHCO3溶液呈碱性,说明HCO3-水解沉淀大于电离程度,c(OH-)>c(H+),故A错误;
B.由溶液呈电中性有电荷守恒关系:c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),故B错误;
C.根据化学式NaHRO3得物料守恒关系:c(Na+)=c(HRO3-)+c(RO32-)+c(H2RO3),故C正确;
D.同浓度的两溶液中,c(Na+)相等,c(HRO3-)不一定相等,c(SO32-)>c(CO32-),故D错误;
故选C.
点评 本题考查离子浓度的大小比较,题目难度中等,解答本题时注意从守恒的角度分析,本题中还要注意题目要求,即浓度均为浓度均为0.1mol•L-1的NaHSO3溶液和NaHCO3溶液中均存在的关系,为易错点.


科目:高中化学 来源: 题型:填空题
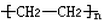 .
.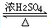 CH3COOC2H5+H2O,反应类型是酯化或取代反应.
CH3COOC2H5+H2O,反应类型是酯化或取代反应.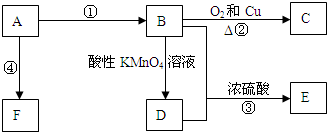
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 124 g P4含有P-P键的个数为4NA | |
| B. | 12 g石墨中含有C-C键的个数为1.5NA | |
| C. | 12 g金刚石中含有C-C键的个数为4NA | |
| D. | SiO2晶体中存在四面体结构单元,O处于中心,Si处于4个顶角 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na | B. | Mg | C. | Al | D. | Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫遇水生成亚硫酸,容易引起胃肠道反应 | |
| B. | 人体直接吸入二氧化硫易引起呼吸道疾病 | |
| C. | 二氧化硫引起的环境问题主要是酸雨 | |
| D. | 可通过服入碱性物质(如NaOH)的方法来消除二氧化硫中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2}{9}$ | B. | $\frac{2}{3}$ | C. | $\frac{1}{3}$ | D. | $\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
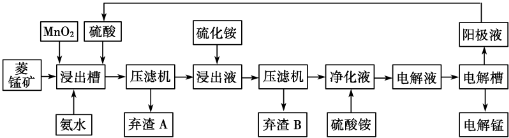
| 物质 | Fe(OH)2 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 7.5 | 7.7 | 7.6 | 8.3 | 2.7 |
| 完全沉淀pH | 9.7 | 8.4 | 8.2 | 9.8 | 3.8 |
| 难容物质 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | NiS | CoS |
| pKsp | 38.55 | 15.26 | 14.7 | 18.49 | 20.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②①④③⑤ | B. | ②③④①⑤ | C. | ②③⑤④① | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com