
| KW |
| C(OH-) |
| KW |
| C(OH-) |
| 10-14 |
| 0.01 |


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:

| Li |
| Li+ |
| Cl2 |
| Cl- |
| S |
| S2- |
| S4+ |
| S |
查看答案和解析>>
科目:高中化学 来源: 题型:
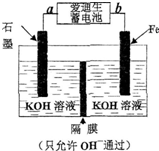 铁及其化合物均为重要化合物.回答下列问题
铁及其化合物均为重要化合物.回答下列问题| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/m01 | 1.0 | 1.5 | 1.0 | 1.0 |
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内气体的密度不随时间而变化 |
| B、容器内的总压强不随时间而变化 |
| C、单位时间内生成2nmol AB的同时,生成nmol的B2 |
| D、A2、B2、AB的反应速率比为1:1:2的状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积).查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| A、中性溶液的AG=1 |
| B、酸性溶液的AG<0 |
| C、常温下0.lmol/L氢氧化钠溶液的AG=12 |
| D、常温下0.lmol/L盐酸溶液的AG=12 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(Ⅰ) | B、(Ⅱ) |
| C、(Ⅲ) | D、(Ⅱ)和(Ⅲ) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| Al2O3 | Fe2O3 | |
| 铝土矿 | 55% | 16% |
| 赤 泥 | 15% | 48% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com