
| A. | 合金的熔点一般比组分金属高 | B. | 合金中只含金属元素 | ||
| C. | 合金的机械性能一般比组分金属好 | D. | 合金的硬度一般比组分小 |
分析 合金是在一种金属中加热熔合其他金属或非金属而形成的具有金属特性的物质,具有硬度大,熔点较各组分金属低的特点,以此解答该题.
解答 解:A.合金的熔点一般比组分金属低,故A错误;
B.合金是在一种金属中加热熔合其他金属或非金属而形成的具有金属特性的物质,如生铁中含C,故B错误;
C.一般来说,合金的熔点比各成分的熔点低,但硬度比各成分硬度高,合金的机械性能一般比组分金属好,故C正确;
D.合金的硬度一般比组分大,故D错误.
故选C.
点评 本题考查合金的性质,为高频考点,侧重于化学与生活的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意把握合金与金属单质的组成、性质以及用途的差异,题目难度不大.


科目:高中化学 来源: 题型:解答题
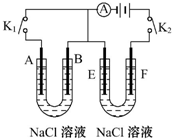 如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.
如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
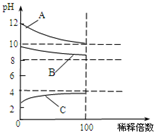 现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH
现有常温时浓度相同的五种电解质溶液:①CH3COOH ②Na2CO3 ③HNO3④CH3COONa ⑤NaOH查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 物质 | 熔点℃ | 沸点℃ | 溶解性 | ||
| 水 | 醇 | 醚 | |||
| 浓H2SO4 | 10.35 | 340 | 互溶 | 互溶 | 互溶 |
| 乙醚 | -89.12 | 34.5 | 微溶(在盐溶液中溶解度降低) | 互溶 | 互溶 |
| 乙醇 | -114.5 | 78.4 | 极易溶 | 极易溶 | 极易溶 |
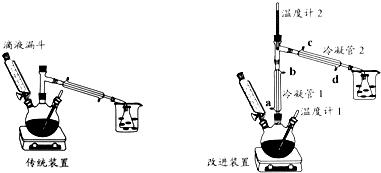
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
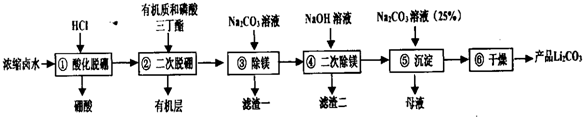
| 物质 | MgCO3 | Li2CO3 | Mg(OH)2 |
| Ksp | 6.82×10-6 | 8.2×10-4 | 5.6×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ca(HCO3)2与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| B. | 向AgCl悬浊液中加入KI溶液:AgCl(s)+I-(aq)═AgI(s)+Cl-(aq) | |
| C. | 实验室保存的氯化亚铁溶液在空气中被氧化:4Fe2++O2+4H+═4Fe3++2H2O | |
| D. | 饱和Na2CO3溶液吸收少量HCl尾气:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
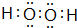
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧元素的相对原子质量一定是$\frac{12a}{b}$ | |
| B. | 该氧原子的摩尔质量是aNAg | |
| C. | Wg该氧原子的物质的量是$\frac{W}{{(a•N}_{A})mol}$ | |
| D. | Wg该氧原子所含质子数是$\frac{16W}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
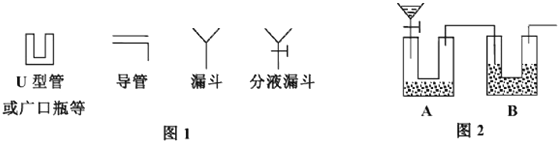

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com