
【题目】用酸性氢氧燃料电池为电源进行电解的实验装置如图所示。下列说法中,错误的是( )。
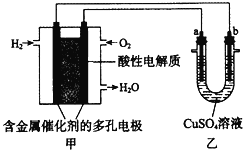
A.燃料电池中通入氢气一端的多孔电极为负极
B.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4 OH-
C.该燃料电池的总反应式为:2H2+O2=2H2O
D.乙装置可实现将电能转化为化学能
科目:高中化学 来源: 题型:
【题目】气态烃A中碳元素与氢元素的质量比为6︰1.淀粉在一定条件下水解可生成B。B在人体组织中缓慢氧化,放出热量,提供生命活动所需能量。有关物质的转化关系如下图:
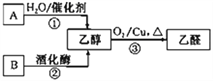
请回答:
(1)①的反应类型是_________________。
(2)向试管中加入2 mL10%氢氧化钠溶液,滴加4~5滴5%硫酸铜溶液,振荡后加入2 mL10% B溶液,加热。写出加热后观察到的现象_____________________________。
(3)反应③的化学方程式是__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为比较Fe3+和Cu2+对H2O2分解的催化效果,甲乙两组同学分别设计了如图一、图二所示的实验。
(1)可通过观察图一的现象:_______________,而定性比较得出结论。有同学提出将CuSO4改为CuCl2更为合理,其理由是_____________,你认为还可以作何改进?____________________。
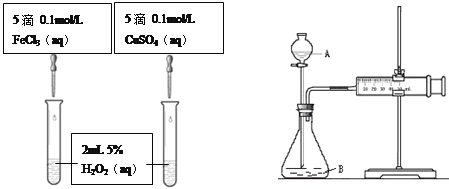
图一 图二
(2)检查图二装置气密性的方法是_______________________。图二所示实验中需测量的数据是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiCl2是化工合成中最重要的镍源。工业上利用含镍(Ni)废催化剂(主要含有Ni,还含有SiO2、Al2O3、Fe及其它不溶于酸、碱的杂质)生产氯化镍晶体(NiCl2·nH2O)流程如下:
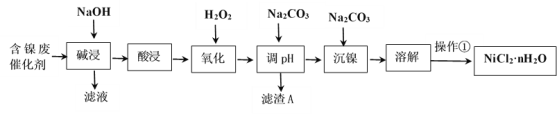
部分金属氢氧化物Ksp近似值如下表所示:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-38 | 10-34 | 10-15 |
回答下列问题:
(1)Ni的原子序数为28,位于元素周期表第四周期,最外层电子数为2,则其原子结构示意图为________________。
(2)“酸浸”、“溶解”所使用的酸为_____________。“碱浸”时发生反应的离子方程式为SiO2+2OH-=SiO32-+H2O、___________________。
(3)“氧化”加入H2O2溶液,其作用是____________________(用离子方程式表示)。然后调节pH使溶液中铁元素恰好完全沉淀(离子浓度≤10-5mol·L-1时,离子沉淀完全),此时常温下的pH约为____________。
(4)“操作①”的实验操作依次为缓缓加热,浓缩至_________________________为止、冷却结晶、过滤、洗涤、干燥,即得产品。
(5)为了测定NiCl2nH2O中结晶水数目进行如下实验:取23.8 g样品在一定条件下脱水得13.0 g NiCl2,则n=__________。
(6)镍氢电池已成为混合动力汽车的主要电池类型,其在碱性电解质溶液的工作原理如下:M+Ni(OH)2![]() MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式__________________。
MH+NiOOH(式中M为储氢合金)。写出电池充电过程中阳极的电极反应式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列用来表示物质变化的化学用语错误的是( )。
A.氢氧燃料电池在碱性介质中的正极反应式:O2 + 2H2O + 4e-= 4 OH-
B.用惰性电极电解饱和氯化钠溶液的离子方程式为:2C1一+ 2H2O = H2↑+ Cl2↑+ 2OH-
C.钢铁发生电化学腐蚀的负极反应式:Fe - 3e- = Fe3+
D.粗铜精炼时,与电源负极相连的是纯铜,电极反应式为:Cu2+ + 2e-= Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将0.3 mol CO2 和0.2 mol H2通入2 L密闭容器中,进行反应:CO(g)+ H2O(g) ![]() CO2(g)+ H2(g)。下列关于该反应建立平衡的说法正确的( )
CO2(g)+ H2(g)。下列关于该反应建立平衡的说法正确的( )
A.反应刚开始时,生成物浓度最大,正反应速率最小
B.随着反应的进行,反应物浓度逐渐减小,正反应速率逐渐增大
C.达到平衡状态时反应体系中CO2的浓度为0 mol˙L-1
D.该反应建立平衡过程中v―t(时间)图像如图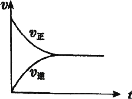
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnSO4H2O是一种易溶于水的微红色斜方晶体,某同学设计下列装置制备硫酸锰:下列说法错误的是
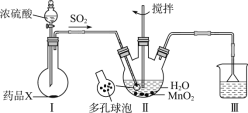
A.装置I烧瓶中放入的药品X为Na2SO3
B.装置II中用“多孔球泡”可增大SO2的吸收速率
C.装置Ⅲ烧杯中溶液为饱和NaHSO3
D.用装置II反应后的溶液制备MnSO4H2O需经历蒸发浓缩、冷却结晶、过滤洗涤干燥等过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过加入适量乙酸钠,设计成微生物电池可以将废水中的氯苯转化为苯而除去,其原理如图所示。下列叙述正确的是
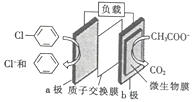
A. b极为正极,发生还原反应
B. 一段时间后b极区电解液的pH减小
C. H+由a极穿过质子交换膜到达b极
D. a极的电极反应式为![]() -e-=Cl-+
-e-=Cl-+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图A为浸透饱和氯化钾溶液和酚酞试液的滤纸,B为电镀槽、回答下列问题:

(1)闭合K1打开K2,滤纸A的左端显________(填“蓝色”“红色”或“无色”);滤纸A上发生的总化学方程式为________________;
(2)欲在铁片上镀锌,则X的电极材料为________,镀件为________(填“阴”或“阳”)极;电镀时应将K1、K2同时闭合,电极Y上发生的电极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com