
化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验,回答相关问题。
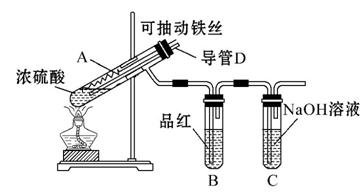
(1)用“可抽动铁丝”代替“直接投入铁片”的优点是____________
(2)能说明有SO2气体产生的实验现象是___________ _
(3)反应后,不需要打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是______ ______
(4)反应一段时间后,他们对A中溶液的金属离子进行探究,请完成相关问题。
①提出假设:
假设1:只含有Fe3+;
假设2: ___ _________;
假设3:既有Fe2+,又有Fe3+。
②设计实验方案验证假设3。写出实验步骤、预期现象和结论。
限选试剂及仪器:稀硫酸、KMnO4溶液、NaOH溶液、淀粉-KI溶液、H2O2溶液
| 实验步骤 | 预期现象和结论 |
| 步骤一:用胶头滴管取A试管中的溶液,用水稀释并分装试管Ⅰ、Ⅱ备用 | |
| 步骤二:往试管Ⅰ中, ____________ | |
| 步骤三: |
(1)抽动铁丝可灵活控制反应开始和停止。
(2)有漂白性,若品红溶液褪色,则说明生成了SO2。
(3)在反应过程中,D导管插入液面下,不会有气体逸出,反应结束后可通过D导管鼓气,将生成的气体全部鼓出,最终被氢氧化钠溶液完全吸收。
(4)可分别取试样,依据Fe2+和Fe3+的特性,选取KMnO4溶液检验Fe2+,选取淀粉-KI溶液检验Fe3+。
答案:(1)便于控制反应的发生和停止
(2)品红溶液褪色
(3)从D管口向A中大量鼓气
(4)只含有Fe2+
| 实验步骤 | 预期现象和结论 |
| 步骤二:滴加少量的淀粉-KI溶液 | 若溶液变蓝色,则原溶液中含有Fe3+ |
| 步骤三:往试管Ⅱ滴加少量的KMnO4溶液 | 若溶液褪色(浅红),则原溶液中含有Fe2+,结合步骤二溶液变蓝,则假设3正确 |


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
高铁电池是一种新型可充电电池,与普 通高能电池相比,该电池能
通高能电池相比,该电池能
长时间保持稳定的 放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
A.放电时负极反应为:3Zn-6e-+6OH-====3Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH- FeO42- +4H2O
FeO42- +4H2O
C.放电时每转移3 mol电子,正极有 1 mol K2FeO4被还原
1 mol K2FeO4被还原
 D.充电时阴极溶液的碱性减弱
D.充电时阴极溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
Al2O3、Al(OH)3都是重要化工原料。根据要求回答问题:
Ⅰ、电解法制高品质Al(OH)3装置如右(中间用离子交换膜隔开):
 4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
4Na[Al(OH)4]+2H2O 4Al(OH)3↓+4NaOH+O2↑+2H2↑
(1)产物Al(OH)3在 区(填“阴极”或“阳极”)沉积;
(2)电解中转移2mol e—时,将制得__________mol的Al(OH)3。
Ⅱ、制取纳米Al2O3需要纯净的硫酸铝。现有0.05mol·L-1硫酸铝溶液,经检测,含有Fe2+、Fe3+。可按下述操作提纯:往溶液中加足量H2O2充分反应,再用试剂X调节溶液pH=3.5。(室温下,0.1mol·L-1的Fe2+、Al3+开始沉淀的pH分别为7.0和3.7,Fe3+完全沉淀的pH=3.2)
(3)纳米氧化铝分散在分散剂中将形成胶体。则纳米氧化铝的直径约为 m。
(4)检验硫酸铝溶液含有Fe3+时,所采用的试剂及现象是 。
(5)往溶液中加入H2O2的作用是 (用离子方程式表示)。
(6)加入的X试剂(填选项编号)是 。
A.CuO B.Al(OH)3 C.NaOH D.NaHCO3
若调节后溶液的pH偏离3.5,可能带来的后果是
。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制氯气有如下几步操作:
①在烧瓶内装入MnO2粉末;②塞好带导管和分液漏斗的双孔塞;③由分液漏斗向烧瓶中注入浓盐酸;④用铁夹固定圆底烧瓶;⑤检查气密性;⑥放好酒精灯;⑦点燃酒精灯;⑧放好铁圈和石棉网,正确的操作顺序是( )
A.①②③④⑧⑤⑥⑦
B.⑤①②③⑧④⑥⑦
C.⑤⑥⑧①②③④⑦
D.⑥⑧⑤①②④③⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案不能达到实验目的的是( )
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2 mL 1 mol·L-1NaOH溶液中先加入3滴1 mol·L-1MgCl2溶液,再加入3滴 1 mol·L-1FeCl3溶液 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入足量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D | 探究温度对化学平衡的影响 | 将NO2球浸泡在冷、热水中,观察颜色的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g)  C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=________;ΔH________0(填“>”“<”或“=”)。
(2)830 ℃时,向一个5 L的密闭 容器中充入0.20 mol的A和0.80 mol的B,若测得反应初始至6 s内A的平衡反应速率v(A)=0.003 mol·L-1·s-1,则6 s时c(A)=________mol·L-1;C的物质的量为________mol。
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为________;如果这时向该密闭容器中再充入1mol氩气,则平衡时A的转化率________(填“增大”“减小”或“不变”)。
(4)判断该反应是否达到平衡的依据为________(填正确选项的字母)。
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(A)不随时间改变
D.单位时间里生成C和D的物质的量相等
(5)1 200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为________。
A(g)+B(g)的平衡常数的值为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
由CH3CH3→CH3CH2Cl→CH2=CH2→CH3CH2OH的转化过程中,经过的反应类型
是( )
A.取代反应→加成反应→氧化反应
B.裂解反应→取代反应→消去反应
C.取代反应→消去反应→加成反应
D.取代反应→消去反应→裂解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期律产生的根本原因就是随着元素原子序数的递增
A.元素的相对原子质量逐渐增大
B.核外电子排布呈周期性变化
C.原子半径呈周期性变化
D.元素主要化合价呈周期性变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com